🌿
Week 3 Chemie
Chemisch rekenen molrekenen
Hoofdstuk 6 Chemical reactions : Mole and Mass Relationships
The coefficients in a balanced chemical equation tell how many molecules, and thus how many moles,
of each reactant are needed and how many molecules, and thus, moles, of each product are formed.
The coefficients can be put in the form of mole ratios, which act as conversion factors when setting up
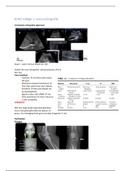
factor label calculations. The mole ratio in the photo will be for H2 to N2 3:1, for H2 to NH3 3:2 and for
N2 to NH3 1:2
You need to be able to carry out 3 kinds of conversions when doing chemical arithmetic.
Mole to mole conversions are carried out using mole ratios as conversion factors
Mole to mass and mass to mole conversions are carried out using molar mass as a conversion
factor.
Mass to mass conversions are frequently needed but cannot be carried out directly. If you know
the mass of substance A and need to find the mass of substance B, you must first convert the
mass of A into moles of A, then carry out a mole to mole conversion to find moles of B, and then
convert moles of B into the mass of B
Overall, there are four steps for determining mass relationships
Stap 1 : Write the balanced chemical equation
Stap 2 : Choose molar masses and mole ratios to convert the known information into the needed
information
Stap 3 : Set up the factor label expressions
Stap 4 : Calculate the answer and check the answer against the ballpark estimate you made before you
began your calculations
The reactant that is exhausted first in such a reaction (oxygen in case of the candle) is called the
limiting reagent. The amount of product you obtain if the limiting reagent is completely consumed is
called the theoretical yield of the reaction. One way to identify the limiting reagent is to compare the
mole ratio of reactants in the balanced chemical equation with the actual amounts of reactants
available.
Actual yield : the amount of product actually formed in a reaction.
The amount of product actually obtained in a reaction is usually expressed as a percent yield :
Week 3 Chemie 1
Week 3 Chemie
Chemisch rekenen molrekenen
Hoofdstuk 6 Chemical reactions : Mole and Mass Relationships
The coefficients in a balanced chemical equation tell how many molecules, and thus how many moles,
of each reactant are needed and how many molecules, and thus, moles, of each product are formed.
The coefficients can be put in the form of mole ratios, which act as conversion factors when setting up
factor label calculations. The mole ratio in the photo will be for H2 to N2 3:1, for H2 to NH3 3:2 and for
N2 to NH3 1:2
You need to be able to carry out 3 kinds of conversions when doing chemical arithmetic.
Mole to mole conversions are carried out using mole ratios as conversion factors
Mole to mass and mass to mole conversions are carried out using molar mass as a conversion
factor.
Mass to mass conversions are frequently needed but cannot be carried out directly. If you know
the mass of substance A and need to find the mass of substance B, you must first convert the
mass of A into moles of A, then carry out a mole to mole conversion to find moles of B, and then
convert moles of B into the mass of B
Overall, there are four steps for determining mass relationships
Stap 1 : Write the balanced chemical equation
Stap 2 : Choose molar masses and mole ratios to convert the known information into the needed
information
Stap 3 : Set up the factor label expressions
Stap 4 : Calculate the answer and check the answer against the ballpark estimate you made before you
began your calculations
The reactant that is exhausted first in such a reaction (oxygen in case of the candle) is called the
limiting reagent. The amount of product you obtain if the limiting reagent is completely consumed is
called the theoretical yield of the reaction. One way to identify the limiting reagent is to compare the
mole ratio of reactants in the balanced chemical equation with the actual amounts of reactants
available.
Actual yield : the amount of product actually formed in a reaction.
The amount of product actually obtained in a reaction is usually expressed as a percent yield :
Week 3 Chemie 1