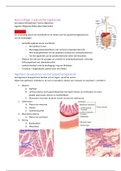
Metabolisme (stofwisseling) is de overkoepelende naam voor twee processen:
katabolisme (afbraak) en anabolisme (opbouw). Bij katabolisme worden
grote moleculen afgebroken in kleine moleculen, waarbij energie vrijkomt. Voor
anabolisme is juist energie nodig.
Suikers, vetten, eiwitten zijn belangrijk bij metabolisme. Deze worden afgebroken
om nieuwe moleculen te kunnen bouwen: suikers in glucose moleculen, vetten in
kleine vetten en eiwitten in aminozuren. Hierbij worden bindingen verbroken: er
komt energie vrij.
De kleine moleculen worden gebruikt om nieuwe moleculen te maken:
Nucleïnezuren (van alles wat) DNA en RNA
Aminozuren Specifieke eiwitten Stofwisselingsroutes Cellen,
weefsels, lichaam
Vetten Membraanlipiden Cytoplasma- of kernmembraan, ER
Stoffen worden naar eigen wensen gebouwd (wat er nodig is).
Redox
Redoxreacties geven elektronen over. Deze elektronen gaan van een molecuul
met een hoog energieniveau naar een molecuul met een laag energieniveau.
Hierbij verliezen de elektronen dus energie: vrije energie. Deze energie kan
gebruikt worden.
Oxidatie is het verliezen van elektronen (oxidatie = reductor wordt oxidator,
dus verliest zijn elektronen). Reductie is het opnemen van elektronen (reductie
= oxidator wordt reductor, dus neemt elektronen op). Een molecuul dat zijn
elektronen wil afgeven heet een reducerend molecuul. Is het reducerend
molecuul z’n elektronen kwijt, dan is het een geoxideerd molecuul geworden.
Dus: Als je gereduceerd wordt, ontvang je elektronen en als je geoxideerd wordt,
geef je elektronen af.
Een redoxreactie verloopt alleen als er meer vrije energie vrijkomt dan dat er
vrije energie ingestoken moet worden. Vrije energie wordt weergegeven in
‘delta’ Gibbs. Dit moet altijd negatief zijn, aangezien je dan dus netto vrije
energie hebt verloren. Deze vrijgekomen energie kun je dan immers gebruiken.
Energie kun je uitdrukken in volt. Als de oxidatie meer oplevert dan de reductie
kost, verloopt de reactie. Dit levert een positief voltage.
Ontvanger (reductie reactie) – gever (oxidatie reactie) = energie in volt
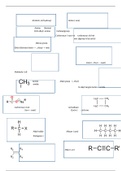
Voorbeeld van koper en zink:
Reacties: energie (V):
Cu2+ + 2e- -> Cu (ontvangt elektronen dus reductie reactie) +0.337
+ -
Zn -> Zn 2 + 2e (geeft elektronen dus oxidatie reactie) - 0.763 -
+1.100
,Hoe groter het voltage, hoe grager een atoom/molecuul een elektron
wil.
Reacties op cellulair niveau verlopen dus omdat er meer energie
vrijkomt dan dat er in is gestopt.
Bij chemische energie komt er energie vrij door het verbreken van een binding.
Vaak gaat het hierbij om ATP. De fosfaatgroepen in ATP hebben een negatieve
lading, waardoor ze elkaar afstoten. Door een binding blijven deze echter bij
elkaar. Bij het verbreken van de binding komt energie vrij. Hierbij komen dus
geen elektronen vrij.
In biologische systemen wordt vooral glucose (reductor) geoxideerd tot CO2. O2
dient hierbij als oxidator (omdat O2 graag elektronen wil hebben) en wordt hierbij
omgezet in H2O.
Vet bevat veel energie en dus veel elektronen. Deze stof wordt dan ook
geoxideerd:
Vet Alcohol Aldehyde Zuur CO2 . Bij elke stap komen er 2 elektronen
vrij.
De elektronen die vrijkomen moeten ergens worden opgeslagen. Het molecuul
dat dit vooral doet is NAD+. Dit is een groot molecuul zodat de reactie stabiel
gebeurt. Hij geeft de elektronen pas af wanneer dat nodig is. NAD+ + H+
+ 2e- NADH
NAD+ is een elektronen acceptor (neemt de elektronen op), NADH is een
elektronen donor (geeft de elektronen af).
O2 is een molecuul dat graag elektronen wil: 0,820 V. De stoffen met een lager
voltage willen dus minder graag elektronen dan O 2. Als er zuurstof aanwezig is
kunnen er dus een hoop reacties verlopen (oxidaties). Als NADH zijn elektronen
afgeeft aan zuurstof, komt er veel energie vrij.
Als er geen zuurstof is, kan een cel een klein beetje energie vrijmaken uit alcohol.
Het alcohol wordt omgezet in en aldehyde, waarbij gebruik wordt gemaakt van
de elektronen van NADH. Daarna wordt aldehyde omgezet in zuur. De tweede
stap levert meer energie dan dat de eerste stap kost, waardoor de reactie dus
verloopt.
Naast NAD+ is er nog een elektronen acceptor: FAD. FAD wil eigenlijk nog grager
elektronen dan NAD+. De reactie met FAD verloopt dus gemakkelijker. Er is dan
ook minder energie nodig om de reactie met FAD te laten verlopen. Maar FAD
staat dichter bij zuurstof, waardoor er minder energie vrijkomt bij de reactie.
FAD + 2 H+ + 2e- FADH2
Het voordeel van FAD is dat het vaak aan enzymen gekoppeld zit en dus dicht bij
de reactie zit. Hierdoor kan hij de elektronen snel doorgeven, zonder ze eerst los
te koppelen (zoals NAD+).
De energiedragers NADH en FADH2 gaan met hun energie naar een plaats waar
nieuwe moleculen worden gemaakt. Daar kunnen zij hun elektronen (cement)
, afgeven zodat er een grote moleculen gemaakt kunnen worden. De andere
energieleveraar is ATP (alleen is dit de chemische component).
NADH levert elektronen, ATP levert energie. We moeten dus NADH omzetten in
ATP, zodat we de energie kunnen gebruiken. Dit gebeurt via een
elektrochemische gradiënt.
Co-enzym A is een heel lang stabiel molecuul dat je aan een ander molecuul
kunt zetten, waardoor een molecuul uit elkaar valt. Het is een belangrijke
katalysator die steeds wordt gebruikt om de productie van ATP in gang te
zetten. Zonder co-enzym A wordt de citroenzuurcyclus ernstig verstoord. Het is
actief in alle lichaamscellen en in bloed. Co-enzym A is tijdens de ATP productie
de startmotor en de batterij.
Principe van activatie:
A + co-enzym Co-enzym A activatie stap
Co-enzym A + B A-B + co-enzym energie leverende stap
Als je glucose gaat afbreken maak je er CO 2 en H2O van. Je moet dit soort
moleculen daarvoor eerst activeren (door fosfaat eraan te zetten).
Toetsvraag: Organisme dat groeit met aantal stoffen, welke stof oxideert, welke
stof reduceert en hoeveel energie komt vrij (in volt)
Per dag gebruiken wij 40 kg ATP. In de laatste binding van ATP zit veel energie. Bij
het verbreken van die verbinding komt die energie dus vrij.
Er kunnen geen reacties van de cel ademhaling plaatsvinden zonder enzymen!
De cel ademhaling (metabolisme) bestaat uit 3 stappen:
- Glycolyse
- Citroenzuurcyclus
- Oxidatieve fosforylering
Bij glycolyse en bij de citroenzuurcyclus worden elektronen “omgezet” in NADH
en FADH2.
Bij de oxidatieve fosforylering worden NADH en FADH 2 “omgezet” in ATP.
Glycolyse
Glycolyse levert energie (waarvan gelijk ATP gemaakt wordt) en geeft de
elektronen die daarbij vrijkomen aan NAD+. Tijdens de glycolyse wordt glucose
omgezet in 2 pyruvaat (C3H6O3) moleculen (+H2O). Dit gebeurt in 10 stappen:
1. Hexokinase: fosfaatgroep van ATP bindt zich aan de glucose. ATP wordt
ADP.
2. Phosphogluco isomerase: glucose (6-ring) wordt fructose (5-ring).
3. Phosphofructokinase: fosfaatgroep van ATP bindt zich aan de fructose.
ATP wordt ADP.
4. Aldolase: fructose (met 2 fosfaten) splitst zich in 2 delen/moleculen:
alleen glyceraldehyde-3-phosphate kan verder reageren.