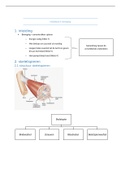
B-B1MB05
,Eenheid 1: De rol van scheikunde in biologie
,2: Atomen en Moleculen
Opbouw van atomen, atoomnummer & atoommassa
Atomen bestaan uit drie subatomische deeltjes:
-protonen positief geladen deeltje 1 Dalton
-neutronen neutraal deeltje 1 Dalton
-elektronen negatief geladen deeltje
Atoomkern protonen + neutronen
-elektronen vormen 'wolk' eromheen
Atoomnummer aantal protonen Massagetal
-bepaald element Element
Atoomnummer
Massa getal protonen + neutronen
-ongeveer gelijk aan atoom massa
Verschil tussen 2 isotopen van element
Ze hebben hetzelfde atoomnummer, maar ander massagetal.
-verschil in aantal neutronen
Verschillende type bindingen covalente en non-covalente
Covalente binding interactie waarbij twee atomen elektronenpaar delen
-elektronegativiteit bepaald polariteit
Non-covalente binding interactie waarbij twee atomen elektronenpaar niet delen
-bijv. ionbindingen, waterstofbruggen & vanderwaalskrachten
Ionbinding interactie waarbij elektron van ene atoom wordt overgedragen aan andere atoom
-om te voldoen aan valentie aantal bindingen
, Met elektronegativiteit polariteit bepalen
Polaire covalente binding atomen delen elektron gelijkmatig
-verschil elektronegativiteit 0,5
Apolair niet-polaire covalente binding atomen delen elektron niet gelijkmatig
-verschil elektronegativiteit 0,5 - 1,6
-zorgt voor partiele ladingen in molecuul
Sterkte van verschillende soorten bindingen
Covalente binding erg sterk
Ionbinding relatief sterk
-aantrekking tussen anion negatief geladen ion en kation positief geladen ion
Waterstofbruggen niet te sterk & niet te zwak
-onstaat als waterstofatoom dat covalent gebonden is aan elektronegatief atoom ook wordt
aangetrokken door ander elektronegatief atoom
Vanderwaalskrachten zwak
-onstaat tussen moleculen die dicht bij elkaar staan als gevolg van ongelijke verdeling van
ladingen
Elektronen in schil 1 en 2 verdelen over verschillende orbitalen
Orbitaal driedimensionale ruimte waarin elektron zich 90% van tijd elektron bevindt
-laat zien dat elektronenschillen niet exactle locatie van elektronen weergeven
-elke orbital bestaat uit 2 elektronen in schil 1 max 2 elektronen & in schil 2 max 8
elektronen
-schil 1 1 orbitaal : 1s
-schil 2 4 orbitalen : 2s, three 2p xyz