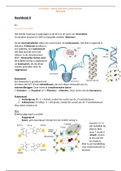
voorstellingen en voorstellingswijzen-functionele groepen
koolstofverbindingen: de bindingen in organische moleculen
- C = basis
- H, O, N, S, Cl, Br, I
- C streeft altijd naar een octetstructuur
Factoren die de chemische eigenschappen bepalen
- Soort binding: covalent of ionbinding
- Ruimtelijke structuur van een molecule is belangrijk
- Meerdere modellen om bindingen te verklaren:
o Valentiebindings theorie
o Molecuul-orbitaal theorie
Kwantummechanica
De Schrödinger vergelijking is de basis om uit te zoeken waar het meeste kans is om een
elektron te vinden
De golffunctie is nodig om de vorm van het orbitaal te kunnen tekenen
Het kwadraat van die golflengte geeft aan hoe groot de kans is om een elektron aan te
treffen op die plaats.
Orbitalen zijn slechts mogelijk bij een welbepaalde energie inhoud
,Elektronenconfiguratie
hoofdniveau subniveau magnetisch notatie aantal orbitalen
n l quantumgetal per subniveau
ml
1 0 0 1s 1
2 0 0 2s 1
1 -1 , 0 , 1 2px , 2py , 2pz 3
3 0 0 3s 1
1 -1 , 0 , 1 3px , 3py , 3pz 3
2 -2 ,-1 , 0 , 1 , 2 3dxy , 3dxz , 3dyz , 5
3dx2-y2 , 3dz2
4 0 0 4s 1
1 -1 , 0 , 1 4px , 4py , 4pz 3
2 -2 ,-1 , 0 , 1 , 2 4dxy , 4dxz , 4dyz , 5
4dx2-y2 , 4dz2
3 -3 , -2 ,-1 , 0 , 1 , 2 , 3 4f 7
Hoofd quantumgetal: n grootte
Neven quantumgetal: I vorm
Magnetisch quantumgetal: mI oriëntatie
s-orbitaal → 1 oriëntatie
p-orbitaal → 3 oriëntaties
d-orbitaal → 5 oriëntaties
f-orbitaal → 7 oriëntaties
per orbitaal max 2 elektronen met tegengestelde spin
,diagonaal regel
1s<2s<2p<3s<3p<4s<3d<4p<…
Valentie-bindings theorie <-> molecuul-orbitaal theorie
Overlap van orbitalen: lineaire combinatie van atoomorbitalen
Streven naar volledige bezetten schil nAO → nMO
Orbitalen en hun vorm
I = 0 dus s-orbitaal
I = 1 dus p-orbitaal
, I = 2 dus d-orbitaal
Moleculair orbitaal theorie
ᴪA ᴪB
│ᴪ│2
ᴪ
bindend