Biochemie: samenvatting
HOOFDSTUK 1: STRUCTUUR VAN AMINOZUREN, PEPTIDEN EN EIWITTEN
a. De levensloop van eiwitten
Start: DNA wordt afgeschreven tot mRNA (boodschapper RNA) in de nucleus.
= transcriptie
Daarna: mRNA wordt vertaald naar een eiwit in het cytoplasma door
aaneenschakeling van aminozuren
= translatie
Daarna: oude eiwitten worden terug afgebroken tot herbruikbare aminozuren in
cytoplasma
= degradatie
Half- waarde tijd van eiwitten= tijd nodig om de helft van een bepaald eiwit te
vervangen (structuur vs signaaleiwit)
o Structuureiwitten: lange half waarde tijd omdat deze eiwitten voor belang
zijn voor de structuur van de cel, dus ze kunnen niet zomaar verdwijnen.
o Signaaleiwitten: eiwitten die signalen gaan doorgeven naar groei en reactie
van cellen hebben een korte half waarde tijd omdat bepaalde signalisatie
maar heel kort mogen plaatsgrijpen.
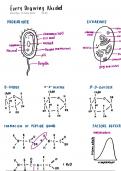
b. Structuur van een aminozuur
Aminozuur is de basis van een eiwit. Meerder
aminozuren vormen peptideketen en meerdere
peptidenketens vormen een eiwit.
Er is een centraal gelegen koolstofatoom (C ) ,
verbonden met een waterstofatoom (H)
En een zwak zure carboxylgroep ( COOH)
En een zwak basische aminogroep (NH2) bij 19
van de 20 aminozuren. Enkel bij proline is het
iminogroep (NH)
En een variabele groep (R ) die de
aminozuuridentiteit bepaalt.
Je moet het kunnen tekenen, herkennen,
elementen herkennen!
c. Structuur van een aminozuur bij pH 7
Zwitterion
= vormt 1 positieve en 1 negatieve groep
o Negatief geladen carboxylaatgroep ( COO-)
o Positief geladen amoniumgroep (NH3+)bij 19 van de 20 aminozuren. Enkel
proline blijft een iminogroep.
d. Naamgeving en structuur van de 20 aminozuren
De specifieke R-groep bepaalt de karakteristieken van een aminozuur.
Niet allemaal vanbuiten kennen, maar wel enkele namen kunnen opsommen.
Hoe naam geven?
o Volledige naam bv Glycine
, o 3 letteraanwijzing bv Gly
o Hoofdletter G
Verschillende eigenschappen voor bepaalde aminozuren
o Sommigen zijn hydrofoob = afkeer van water
Die gaan dus eerder aan de binnenkant van een eiwit zitten.
o Sommigen zijn hydrofiel = graag in waterige omgeving
Die gaan dus eerder aan de buitenkant van een eiwit zitten.
e. Opbouw van eiwitten
Er zijn 4 niveaus van eiwitstructuur : primair, secundair, tertiair, quartair
o Primair: lineaire aminozuurketen: aminozuren zijn aaneengeschakeld. Bv
insuline
o Secundair: vorming van specifieke structuren in een aminozuurketen
o Tertiair: opgevouwen eiwitstructuur. Het is sindsdien een functioneel eiwit.
o Quartair: complexe oligomere eiwitstructuren. Het is een functioneel
eiwitcomplex.
Primaire structuur van eiwitten
o Lineaire keten van aminozuren (residuen) via peptidebinding
o Die koppeling gaat gebeuren via de ammoniumgroep en de carboxylaatgroep
en er splitst een watermolecule af. En wordt hele tijd langer.
o Een peptideketen wordt gevormd en deze heeft een amino (N) en carboxy
(C ) terminus hebben.
o Naamgeving:
1-10 aminozuren: Het aantal aminozuren in een peptideketen wordt
weergegeven door di, tri, tetra, penta,…
10-20 aminozuren: oligopeptides
Meer dan 20: polypeptides
Secundaire structuur van eiwitten
o 3 belangrijke structuren: tussen aminozuren die dicht bij elkaar liggen
Alpha helix:
Beta sheet (bladstructuur)
Omgekeerde draai: keten maakt een omgekeerde draai
o Deze structuren gaan opzich geen functioneel eiwit vormen. Ze worden
bijeengehouden door niet-covalente waterstofbruggen N-H of O-H binding
door elektrostatische aantrekkingskracht.
Tertiaire structuur van eiwitten
o Omvat de finale 3D structuur van een eiwit.
o Bindingen tussen verder gelegen aminozuren
o Verschillende interacties
Hydrofobe interacties: keren zich af van het waterig milieu
Disulfidebruggen ( S-S) : covalente binding tussen 2 -CH2SH
restgroepen
Ionische interacties: + of – geladen die elkaar gaan aantrekken of
afstoten
, o Een 3D eiwitstructuur kan onderverdeeld worden in verschillende domeinen.
( bv transmembranair domein of cytoplasma domein)
o Vb. myoglobine is een zuurstofbindend eiwit dat voorkomt in hart- en
skeletspiercellen.
Het is opgebouwd uit 153 aminozuren.
De secundaire structuur wordt gevormd door 8 alpha helixen
Heeft een bindingsplaats voor een heemgroep
Vormt het actieve centrum van het myoglobine eiwit.
o SERCA pomp: veel groter eiwit
Transporteers Ca2+ vanuit het cytoplasa naar het sarcoplasmatisch
reticulum.
Meerdere secundaire structuren vormen een complexe tertiaire
eiwitstructuur bestaande uit verschillende functionele domeinen.
Quartaire structuur van eiwitten
o Combinatie van individuele subunits ( eiwitten in tertiaire structuur) tot een
functioneel oligomerisch eiwit.
o Het ontstaat door niet- covalente bindingen: waterstofbruggen,
elektrostatische en hydrofobo interacties.
o Vb. myosine: bestaat uit 6 subunits ( 6 individuele tertiaire structuren van
een eiwit gaan samenkomen en een groter geheel vormen als functioneel
eiwit)
2 zware myosineketens
2 essentiële lichte ketens
2 regulerende lichte ketens
, HOOFDSTUK 2:ENZYMEN
a. Wat zijn enzymen?
= eiwitten die optreden als katalysator voor biochemische reacties in ons lichaam.
Je hebt een enzym en je hebt een substraat. Die 2 gaan
een binding aangaan en vervolgens gaat er een
biochemische reactie plaatsgrijpen, waardoor er
eindproducten gaan ontstaan.
Als katalysator versnellen zij chemische reacties door
de activatie-energie van een reactie te verlagen
Je start altijd met een substraat en eindigt met een
eindproduct.
b. Enzymatische reacties
Meest voorkomende enzymreacties zijn reversibele reacties:
o Er gebeuren slechts kleine energieveranderingen
o Het zijn evenwichtsreacties, wat wilt zeggen dat de reactie in 2 richtingen
kan verlopen. Eindproduct is het substraat voor de omgekeerde reactie
o Meer voorkomend in het lichaam
Daar tegenover staan irreversibele reacties:
o Hier is er een grotere energieverandering
o Het zijn geen evenwichtsreacties
o En ze zijn minder voorkomend
c. Verloop van enzymatische reacties
1. Binding E en S tot een enzymsubstraat (ES) complex
2. Conversie tot enzym-intermediair (EI) complex
3. Katalyse tot enzymproduct ( EP) complex
4. Vrijstelling van eindproduct (P) en herbruikbaar enzym (E)
d. Reactiesnelheid van een enzymatische reactie
Grafieken begrijpen is belangrijk voor het
examen!
In dit geval
o x-as: substraatconcentratie
o y-as: snelheid van een enzymatische
reactie
Je hebt een vaste concentratie aan enzymen. Dat
enzyme heeft een substraat nodig. We gaan het
substraat langzaam aan verhogen?
o Lage substraatconcentratie: snelle lineaire stijging van initiële
reactiesnelheid bij stijgende substraatconcentratie.
o Hoge substraatconcentratie: reactiesnelheid neemt niet meer lineair toe en
bereikt een plateau (Vmax)
Extra substraat zal snelheid niet verhogen omdat alle enzymen reeds
werkzaam zijn. (= saturatie)
HOOFDSTUK 1: STRUCTUUR VAN AMINOZUREN, PEPTIDEN EN EIWITTEN
a. De levensloop van eiwitten
Start: DNA wordt afgeschreven tot mRNA (boodschapper RNA) in de nucleus.
= transcriptie
Daarna: mRNA wordt vertaald naar een eiwit in het cytoplasma door
aaneenschakeling van aminozuren
= translatie
Daarna: oude eiwitten worden terug afgebroken tot herbruikbare aminozuren in
cytoplasma
= degradatie
Half- waarde tijd van eiwitten= tijd nodig om de helft van een bepaald eiwit te
vervangen (structuur vs signaaleiwit)
o Structuureiwitten: lange half waarde tijd omdat deze eiwitten voor belang
zijn voor de structuur van de cel, dus ze kunnen niet zomaar verdwijnen.
o Signaaleiwitten: eiwitten die signalen gaan doorgeven naar groei en reactie
van cellen hebben een korte half waarde tijd omdat bepaalde signalisatie
maar heel kort mogen plaatsgrijpen.
b. Structuur van een aminozuur
Aminozuur is de basis van een eiwit. Meerder
aminozuren vormen peptideketen en meerdere
peptidenketens vormen een eiwit.
Er is een centraal gelegen koolstofatoom (C ) ,
verbonden met een waterstofatoom (H)
En een zwak zure carboxylgroep ( COOH)
En een zwak basische aminogroep (NH2) bij 19
van de 20 aminozuren. Enkel bij proline is het
iminogroep (NH)
En een variabele groep (R ) die de
aminozuuridentiteit bepaalt.
Je moet het kunnen tekenen, herkennen,
elementen herkennen!
c. Structuur van een aminozuur bij pH 7
Zwitterion
= vormt 1 positieve en 1 negatieve groep
o Negatief geladen carboxylaatgroep ( COO-)
o Positief geladen amoniumgroep (NH3+)bij 19 van de 20 aminozuren. Enkel
proline blijft een iminogroep.
d. Naamgeving en structuur van de 20 aminozuren
De specifieke R-groep bepaalt de karakteristieken van een aminozuur.
Niet allemaal vanbuiten kennen, maar wel enkele namen kunnen opsommen.
Hoe naam geven?
o Volledige naam bv Glycine
, o 3 letteraanwijzing bv Gly
o Hoofdletter G
Verschillende eigenschappen voor bepaalde aminozuren
o Sommigen zijn hydrofoob = afkeer van water
Die gaan dus eerder aan de binnenkant van een eiwit zitten.
o Sommigen zijn hydrofiel = graag in waterige omgeving
Die gaan dus eerder aan de buitenkant van een eiwit zitten.
e. Opbouw van eiwitten
Er zijn 4 niveaus van eiwitstructuur : primair, secundair, tertiair, quartair
o Primair: lineaire aminozuurketen: aminozuren zijn aaneengeschakeld. Bv
insuline
o Secundair: vorming van specifieke structuren in een aminozuurketen
o Tertiair: opgevouwen eiwitstructuur. Het is sindsdien een functioneel eiwit.
o Quartair: complexe oligomere eiwitstructuren. Het is een functioneel
eiwitcomplex.
Primaire structuur van eiwitten
o Lineaire keten van aminozuren (residuen) via peptidebinding
o Die koppeling gaat gebeuren via de ammoniumgroep en de carboxylaatgroep
en er splitst een watermolecule af. En wordt hele tijd langer.
o Een peptideketen wordt gevormd en deze heeft een amino (N) en carboxy
(C ) terminus hebben.
o Naamgeving:
1-10 aminozuren: Het aantal aminozuren in een peptideketen wordt
weergegeven door di, tri, tetra, penta,…
10-20 aminozuren: oligopeptides
Meer dan 20: polypeptides
Secundaire structuur van eiwitten
o 3 belangrijke structuren: tussen aminozuren die dicht bij elkaar liggen
Alpha helix:
Beta sheet (bladstructuur)
Omgekeerde draai: keten maakt een omgekeerde draai
o Deze structuren gaan opzich geen functioneel eiwit vormen. Ze worden
bijeengehouden door niet-covalente waterstofbruggen N-H of O-H binding
door elektrostatische aantrekkingskracht.
Tertiaire structuur van eiwitten
o Omvat de finale 3D structuur van een eiwit.
o Bindingen tussen verder gelegen aminozuren
o Verschillende interacties
Hydrofobe interacties: keren zich af van het waterig milieu
Disulfidebruggen ( S-S) : covalente binding tussen 2 -CH2SH
restgroepen
Ionische interacties: + of – geladen die elkaar gaan aantrekken of
afstoten
, o Een 3D eiwitstructuur kan onderverdeeld worden in verschillende domeinen.
( bv transmembranair domein of cytoplasma domein)
o Vb. myoglobine is een zuurstofbindend eiwit dat voorkomt in hart- en
skeletspiercellen.
Het is opgebouwd uit 153 aminozuren.
De secundaire structuur wordt gevormd door 8 alpha helixen
Heeft een bindingsplaats voor een heemgroep
Vormt het actieve centrum van het myoglobine eiwit.
o SERCA pomp: veel groter eiwit
Transporteers Ca2+ vanuit het cytoplasa naar het sarcoplasmatisch
reticulum.
Meerdere secundaire structuren vormen een complexe tertiaire
eiwitstructuur bestaande uit verschillende functionele domeinen.
Quartaire structuur van eiwitten
o Combinatie van individuele subunits ( eiwitten in tertiaire structuur) tot een
functioneel oligomerisch eiwit.
o Het ontstaat door niet- covalente bindingen: waterstofbruggen,
elektrostatische en hydrofobo interacties.
o Vb. myosine: bestaat uit 6 subunits ( 6 individuele tertiaire structuren van
een eiwit gaan samenkomen en een groter geheel vormen als functioneel
eiwit)
2 zware myosineketens
2 essentiële lichte ketens
2 regulerende lichte ketens
, HOOFDSTUK 2:ENZYMEN
a. Wat zijn enzymen?
= eiwitten die optreden als katalysator voor biochemische reacties in ons lichaam.
Je hebt een enzym en je hebt een substraat. Die 2 gaan
een binding aangaan en vervolgens gaat er een
biochemische reactie plaatsgrijpen, waardoor er
eindproducten gaan ontstaan.
Als katalysator versnellen zij chemische reacties door
de activatie-energie van een reactie te verlagen
Je start altijd met een substraat en eindigt met een
eindproduct.
b. Enzymatische reacties
Meest voorkomende enzymreacties zijn reversibele reacties:
o Er gebeuren slechts kleine energieveranderingen
o Het zijn evenwichtsreacties, wat wilt zeggen dat de reactie in 2 richtingen
kan verlopen. Eindproduct is het substraat voor de omgekeerde reactie
o Meer voorkomend in het lichaam
Daar tegenover staan irreversibele reacties:
o Hier is er een grotere energieverandering
o Het zijn geen evenwichtsreacties
o En ze zijn minder voorkomend
c. Verloop van enzymatische reacties
1. Binding E en S tot een enzymsubstraat (ES) complex
2. Conversie tot enzym-intermediair (EI) complex
3. Katalyse tot enzymproduct ( EP) complex
4. Vrijstelling van eindproduct (P) en herbruikbaar enzym (E)
d. Reactiesnelheid van een enzymatische reactie
Grafieken begrijpen is belangrijk voor het
examen!
In dit geval
o x-as: substraatconcentratie
o y-as: snelheid van een enzymatische
reactie
Je hebt een vaste concentratie aan enzymen. Dat
enzyme heeft een substraat nodig. We gaan het
substraat langzaam aan verhogen?
o Lage substraatconcentratie: snelle lineaire stijging van initiële
reactiesnelheid bij stijgende substraatconcentratie.
o Hoge substraatconcentratie: reactiesnelheid neemt niet meer lineair toe en
bereikt een plateau (Vmax)
Extra substraat zal snelheid niet verhogen omdat alle enzymen reeds
werkzaam zijn. (= saturatie)