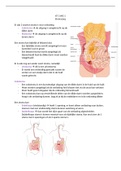
Hoorcollege 1: 16 november 2018
Resonante structuren: het molecuul kan op meerdere manieren getekend worden waarbij het aantal
bindingen (en elektronen) correct blijft. Een voorbeeld hiervan is de structuur van adenine.
De bindingslengte in zo een molecuul ligt bijvoorbeeld precies tussen die van een enkele en een
dubbele. Dit is dus een soort tussenstructuur.
Een molecuul met een resonante structuur is stabieler dan een molecuul zonder resonante structuur.
Omdat de peptide binding ook tussen een enkele en dubbele in zit is dit een stabiele en resonante
structuur.
De sterkte van een waterstofbrug zit tussen 2 en 40 kJ/mol
1e wet van de thermodynamica: het behoud van energie, energie kan niet verdwijnen of ontstaan.
2e wet van de thermodynamica: de totale entropie van een systeem en van zijn omgeving neemt
altijd toe.
Bij de formatie van de DNA dubbel helix komt er heel veel warmte vrij. Zo kan er orde ontstaan in het
buisje maar ontstaat er wanorde in de omgeving. De wanorde in de omgeving komt dus door de
verandering in energie in het systeem. Bij hoge temperatuur is de toename in wanorde van de
omgeving relatief lager, daarom wordt er gedeeld door de temperatuur.
Omdat de wanorde in het systeem altijd
moet toenemen, moet de gibbs vrije
energie dus altijd een negatieve waarde
hebben wilt een reactie spontaan
verlopen.
De formatie van een DNA dubbel helix is
een enthalpie gedreven reactie.
De waterconstante (Kw) = [H+][OH-] = 10-14
Dus bij 0.1 M HCL heldt dat [H+] = 10-1 en [OH-] = 10-13
, Een zuurconstant wordt bepaald door de eindproducten te
delen door de beginproducten. Vervolgens wordt de pKa
bepaald door de -log te nemen van de Ka.
Als de pH gelijk is aan de pKa waarde dan geldt dat de
-log[A]/[Ha] nul is. In dit geval is de verhouding zuur en base
dus 1:1.
Bijvoorbeeld: guanine heeft een pKa van 9,7. Als guanine nu in
een oplossing zit met een pH van 9,7 dan zijn de helft van de
basen zuur en de andere helft basen.
Een buffer is een oplossing met een zwak zuur en zijn
geconjugeerde base. Als hier protonen aan worden
toegevoegd zullen deze een interactie aangaan met de basen.
Hieruit volgt echter niet meteen een verandering van de pH-waarde. Dus er kunnen H + of OH- worden
opgenomen terwijl de pH ongeveer constant blijft. Hiervoor moet het zwakke zuur en de
geconjugeerde basen wel in gelijke delen aanwezig zijn (dus op de pKa waarde). Een zwak zuur is
nodig omdat anders de protonen te snel zouden dissociëren, echter heeft elk zuur rond de pKa
waarde wel een bepaald vermogen tot bufferen.
Met de Handerson – Hasselbar vergelijking kan het punt worden
uitgerekend waarop de oplossing als buffer functioneert. Hiermee kan
bijvoorbeeld berekend worden of een oplossing bij een bepaalde pH kan
functioneren als buffer.
In eiwitten zitten alleen L-isomeren.
Als een aminozuur in een oplossing zit bij een lage pH heeft zowel de zuur als de aminogroep een
proton. Wordt de pH verhoogd dan staat de zuurgroep als eerste een proton af omdat deze groep de
laagste pKa waarde heeft. Op dit punt wordt het aminozuur een zwitterion genoemd. Bij een zeer
hoge pH staat ook de aminogroep het proton af.
Een alifatisch aminozuur heeft veel koolwaterstof moleculen (ala, val, leu, ile, met).
Een ariomatisch aminozuur heeft een ringstructuur.
Histidine heeft een pKa van 6. Onder normale omstandigheden heeft dit molecuul dus een positieve
lading wat betekent dat het veel interacties zal aangaan met negatief geladen groepen.
De binding tussen de zuurgroep van het ene aminozuur en de peptide groep van de volgende kan
eigenlijk niet draaien omdat dit een resonante structuur is. Hierdoor liggen de aminozuren op een
vast vlak in de keten. De bidingen binnen het aminozuur kunnen echter wel draaien. Echter kan niet
elke draaiing zomaar door ongunstige interacties tussen bijvoorbeeld de restgroepen. Dit wordt
weergegeven in een plot, de Ramachandran plot. Alleen de groene plekken op de plot kunnen
voorkomen in eiwitten.
Hoorcollege 2: 23 november 2018
Het proteoom is een verzameling van alle eiwitten van een organisme of een cel. Een proteoom is
complexer dan een genoom omdat een gen zorgt voor een eiwit, maar deze eiwitten kunnen nog
gemodificeerd worden (zoals alternative splicing of fosforylatie enzo). Het eindproduct is dus
complexer dan de code. Alle cellen hebben zo min of meer hetzelfde genoom waar het proteoom
verschilt van cel tot cel.