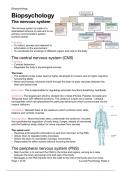
Grundlagen
Nachweisreaktionen
Knallgasprobe - Wasserstoff Gas wird entzündet, Positiv bei Knall/Pfeifen
Glimmspanprobe - Sauerstoff Holzspan wird entzündet und ins Gas gehalten, Positiv bei weiter glühen
Knalkwasserprobe - Kohlenstoffdioxid Gas wird durch Kalkwasser (Calciumhydoxidlösung) geleitet, Positiv bei Trübung
Cerammoniumnitrat - Alkohol Flüssigkeit wird in Cer-Nitratlösung gegeben, positiv bei rot/braun Färbung
Fehlingprobe - Aldehyd Aldehyd wird mit Kupferionen oxidiert, positiv bei Farbumschlag von blau auf orange
Tollensprobe - Aldehyd Silberspiegelprobe, positiv wenn Aldehyd mit Silbernitratlösung und Ammoniaklösung silber wird
Begriffe
Pyrolyse erhitzen mit Sauerstoff-Ausschluss (ohne zusätzlichen)
Hydrolyse Spaltung einer polaren e - Paarbindung durch Reaktion mit Wasser
Kondensationsrkt 2 Moleküle verbinden sich unter Wasserabspaltung
Dehydratisierung Wasserabspaltung aus einem Molekül
Hydratisierung die Anlagerung von Wassermolekülen an gelöste Ionen, wodurch eine Hydrathülle entsteht
Bsp Synthese Alkohol: Wasser + Alken = Alkohol
Protolyse Protonenübertragungsreaktion nach Bronsted-Säure-Base-Theorie, Reaktion mit Wasser
Titration Verfahren zur Ermittlung für unbekannte Konzentrationen
Neutralisation Aufhebung der (ätzenden) Wirkung von Säuren oder Basen
„…at“ Säure vom Molekül (Bsp. Glycerat = Glycerinsäure)
Autoprotolyse GG-Rkt von zwei Wassermolekülen: H wird von einem auf ein anderes Wassermolekül übertragen
nach H aufnahme / -abgabe entsteht jeweils ein Oxonium-Ion und ein Hydroxid-Ion
-
Dissoziation Vorgang der Teilung einer chemischen Verbindung in zwei oder mehrere Moleküle, Atome oder Ionen
Wechselwirkungen
Intermolekular Intramolekular
· H-Brücken · Elektronenpaarbindung
· Dipol-Dipol · Ionenbindung
· VdW-WW
Säure-Base
Säure = Protonendonator
Base = Protonenakteptor (häufig Wasser)
Zwischen Rekationspartnern stellt sich ein chemisches GG ein
pH-Wert: pH < 7 saure Lösung c(H O ) >10 mo
I
-
[c(H 04] {C3 moise
3
pH = 7 neutrale Lösung c(H+ O ) =10 mo
-
pl) =
-log >
imit
) PH
c(HO moye
+ -
pH > 7 alkalische Lösung c(H O ) <10 mo 10
=
+
-
3
Anorganische Säuren:
NAME IONEN SAURERESI INIONEN
HC Salzsäure Chlorid-ion OH--Hydroxidionen
+
H &-
He COz Kohlensäure Carbonat-ion Hz0+
+ =
2H CO, :
Oxoniumionen
Schweflige Säure Sulfid-ion
+
11 , S03 2H SO,
Schwefelsäure Sulfat-ion
+
HeSOn 2H SO -
Salpetersäure Nitrat-ion
+
HNOs H NOz
Phosphorsäure Phosphat-ion
+
3
113PO4 3H PO4
Nachweisreaktionen
Knallgasprobe - Wasserstoff Gas wird entzündet, Positiv bei Knall/Pfeifen
Glimmspanprobe - Sauerstoff Holzspan wird entzündet und ins Gas gehalten, Positiv bei weiter glühen
Knalkwasserprobe - Kohlenstoffdioxid Gas wird durch Kalkwasser (Calciumhydoxidlösung) geleitet, Positiv bei Trübung
Cerammoniumnitrat - Alkohol Flüssigkeit wird in Cer-Nitratlösung gegeben, positiv bei rot/braun Färbung
Fehlingprobe - Aldehyd Aldehyd wird mit Kupferionen oxidiert, positiv bei Farbumschlag von blau auf orange
Tollensprobe - Aldehyd Silberspiegelprobe, positiv wenn Aldehyd mit Silbernitratlösung und Ammoniaklösung silber wird
Begriffe
Pyrolyse erhitzen mit Sauerstoff-Ausschluss (ohne zusätzlichen)
Hydrolyse Spaltung einer polaren e - Paarbindung durch Reaktion mit Wasser
Kondensationsrkt 2 Moleküle verbinden sich unter Wasserabspaltung
Dehydratisierung Wasserabspaltung aus einem Molekül
Hydratisierung die Anlagerung von Wassermolekülen an gelöste Ionen, wodurch eine Hydrathülle entsteht
Bsp Synthese Alkohol: Wasser + Alken = Alkohol
Protolyse Protonenübertragungsreaktion nach Bronsted-Säure-Base-Theorie, Reaktion mit Wasser
Titration Verfahren zur Ermittlung für unbekannte Konzentrationen
Neutralisation Aufhebung der (ätzenden) Wirkung von Säuren oder Basen
„…at“ Säure vom Molekül (Bsp. Glycerat = Glycerinsäure)
Autoprotolyse GG-Rkt von zwei Wassermolekülen: H wird von einem auf ein anderes Wassermolekül übertragen
nach H aufnahme / -abgabe entsteht jeweils ein Oxonium-Ion und ein Hydroxid-Ion
-
Dissoziation Vorgang der Teilung einer chemischen Verbindung in zwei oder mehrere Moleküle, Atome oder Ionen
Wechselwirkungen
Intermolekular Intramolekular
· H-Brücken · Elektronenpaarbindung
· Dipol-Dipol · Ionenbindung
· VdW-WW
Säure-Base
Säure = Protonendonator
Base = Protonenakteptor (häufig Wasser)
Zwischen Rekationspartnern stellt sich ein chemisches GG ein
pH-Wert: pH < 7 saure Lösung c(H O ) >10 mo
I
-
[c(H 04] {C3 moise
3
pH = 7 neutrale Lösung c(H+ O ) =10 mo
-
pl) =
-log >
imit
) PH
c(HO moye
+ -
pH > 7 alkalische Lösung c(H O ) <10 mo 10
=
+
-
3
Anorganische Säuren:
NAME IONEN SAURERESI INIONEN
HC Salzsäure Chlorid-ion OH--Hydroxidionen
+
H &-
He COz Kohlensäure Carbonat-ion Hz0+
+ =
2H CO, :
Oxoniumionen
Schweflige Säure Sulfid-ion
+
11 , S03 2H SO,
Schwefelsäure Sulfat-ion
+
HeSOn 2H SO -
Salpetersäure Nitrat-ion
+
HNOs H NOz
Phosphorsäure Phosphat-ion
+
3
113PO4 3H PO4