Hoofdstuk 8
➢ Enzymregulatie
♥ Enzymen (en dus snelheid van reacties) worden gereguleerd door een aantal factoren
♪ Temperatuur
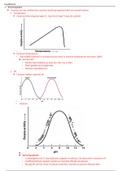
❖ Enzymactiviteit stijgt bij hogere T, maar bij te hoge T stopt de activiteit
•
❖ Extreme temperaturen
• Thermofiele bacteriën en archaea kunnen leven in extreme temperaturen tot boven 100ºC
Hoe kan dit?
○ Minder thermolabiele aa zoals Asn, Gln, Cys en Met
○ Meer geladen aa op oppervlak
○ Sterkere hydrofobe kern
♪ pH
❖ Enzymen hebben optimale pH
•
• Waarom:
Verzuring spieren
○ In afwezigheid van O2 wordt glucose omgezet in melkzuur. Dit dissocieert in lactaat en H+.
○ Fosfofructokinase reguleert aerobe en anaerobe afbraak van glucose.
○ Bij lage pH valt het enzym uit elkaar (meerdere subunits) en glucose afbraak stopt.
, ➢ Inhibitie van enzymen
♥ Reversibel
♪ Competitive inhibition
❖ Competitieve inhibitor bindt aan de active site
❖ Enzym kan binden aan substraat (ES) óf inhibitor (EI),
• maar niet beide (ESI)
❖ Minder ES → snelheid ↓
❖ Oplossing: substraatconcentratie ↑
❖ Kinetisch effect:
•
•
•
• Lineweaver-burk plot:
♪ Uncompetitive
❖ Uncompetitieve inhibitor bindt aan de active site nadat het substraat gebonden is (dus aan ES)
❖ Minder product gevormd → rate ↓
❖ Kan niet worden overkomen door het verhogen van de substraat-concentratie
❖
❖ ESI wordt niet verder omgezet in een product.
•
❖ Kinetisch effect:
•
➢ Enzymregulatie
♥ Enzymen (en dus snelheid van reacties) worden gereguleerd door een aantal factoren
♪ Temperatuur
❖ Enzymactiviteit stijgt bij hogere T, maar bij te hoge T stopt de activiteit
•
❖ Extreme temperaturen
• Thermofiele bacteriën en archaea kunnen leven in extreme temperaturen tot boven 100ºC
Hoe kan dit?
○ Minder thermolabiele aa zoals Asn, Gln, Cys en Met
○ Meer geladen aa op oppervlak
○ Sterkere hydrofobe kern
♪ pH
❖ Enzymen hebben optimale pH
•
• Waarom:
Verzuring spieren
○ In afwezigheid van O2 wordt glucose omgezet in melkzuur. Dit dissocieert in lactaat en H+.
○ Fosfofructokinase reguleert aerobe en anaerobe afbraak van glucose.
○ Bij lage pH valt het enzym uit elkaar (meerdere subunits) en glucose afbraak stopt.
, ➢ Inhibitie van enzymen
♥ Reversibel
♪ Competitive inhibition
❖ Competitieve inhibitor bindt aan de active site
❖ Enzym kan binden aan substraat (ES) óf inhibitor (EI),
• maar niet beide (ESI)
❖ Minder ES → snelheid ↓
❖ Oplossing: substraatconcentratie ↑
❖ Kinetisch effect:
•
•
•
• Lineweaver-burk plot:
♪ Uncompetitive
❖ Uncompetitieve inhibitor bindt aan de active site nadat het substraat gebonden is (dus aan ES)
❖ Minder product gevormd → rate ↓
❖ Kan niet worden overkomen door het verhogen van de substraat-concentratie
❖
❖ ESI wordt niet verder omgezet in een product.
•
❖ Kinetisch effect:
•