Biologie Hoofdstuk 18 - Eiwitten
§18.1 - Van polypeptideketen tot een werkzaam eiwit
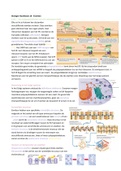
Elke cel in je lichaam kan duizenden
verschillende eiwitten vormen. Deze eiwitten
gaan allemaal naar een eigen plaats. Veel
ribosomen koppelen aan het ER, voordat ze de
translatie voltooien. Adreslabels brengen
eiwitten naar de juiste plaats. Dit bindt aan een
signaalherkenningsmolecuul (SHM) uit het
grondplasma. Translatie stopt tijdelijk (binas
71J). Het SHM hect aan een SHM-receptor van
het ER. Het ribosoom koppelt aan een
ribosoomreceptor van het ER. Eitwitpoort
opent. GTP hecht aan de SHM-receptor. Het GTP
splitst in GDP en Pi en het SHM komt los van zijn
receptor. Een enzym verwijdert het adreslabel.
De translatie gaat verder, de groeiende polypeptideketen komt binen het ER. Bij het stopcodon bindt een
ontkoppelingseiwit aan het mRNA en koppelt de polypeptideketen los van het ribosoom. De eiwitpoort sluit. In
het ER begint de omzetting naar een eiwit - de polypetideketen krijgt zijn ruimtelijke eiwitstructuur.
Membraan van het glad ER vormen transportblaasjes die de eiwitten voor afwerking naar het Golgi-systeem
vervoeren.
Bewerking in het Golgi-systeem
In het Golgi-systeem ontstaat de definitieve eiwitvorm. Enzymen voegen
fosfaatgroepen toe, wijzigen de toegevoegde suikers en/of koppelen
meerdere polypeptideketens aaneen tot een eiwit. De gevormde
eiwitmoleculen vormen membraaneiwitten, gaan via exocytose
(transportblaasje) de cel uit of werken als bouwstof of enzym in de cel.
Ruimtelijke structuur
Eiwitten hebben een specifieke ruimtelijke structuur. De
volgorde en het aantal van elk type aminozuur bepalen de
primaire structuur van een eiwitmolecuul. Een α-helix of een
ꞵ-plaat vormt de secundaire structuur. Deze structuur is het
resultaat van waterstofbruggen tussen de N-H groepen en
C=O groepen van verschillende aminozuren in eiwitten. De
tertiaire structuur is de driedimensionale structuur die tot
stand komen via bindingen tussen de restroepen van
verschillende aminozuren, twee of meer polypeptideketens
samen vormen de quaternaire structuur (binas 67H2).
Vouwen en denaturatie van eiwitten
Chaperonne-eiwitten vouwen onjuist gevormde eiwitten.
Denaturatie is het verlies van de ruimtelijke structuur van een
eiwitmolecuul.
, §18.2 - Functies van eiwitten
Plaques zijn ophopingen van eiwitten tussen de hersencellen. Tangles zijn eiwitkluwens binnen de
hersencellen. Beide verstoren de werking van de hersenen met als gevolg symptomen als geheugenverlies,
verwarde gedachten, desoriëntatie en een slecht beoordelingsvermogen (Alzheimer). Hersencellen maken het
eiwitmolecuul APP. Bij de afbraak van verouderd APP kunnen eiwitfragmenten ontstaan die aaneen klonteren
tot plaques. Tangles in de hersencellen ontstaan door het samenklonteren van tau-eiwitten. Bij gezonde cellen
zijn tau-eiwitten oplosbaar en houden het celskelet van hersencellen in stand door microtubuli: vormen de
transportwegen van de cel. Bij Alzheimer zijn de tau-eiwitten gehyperfosforyleerd, waardoor ze onoplosbaar
worden en het transportsysteem ontregeld.
Motoreiwitten
Motoreiwitten vervoeren organellen en blaasjes met
voedingsstoffen langs de microtubuli. Voet 1 van het
motoreiwit bindt aan de microtubulus, laat ADP los en
neemt vervolgens ATP op. Hierdoor slingert voet 2 naar
voren. Wanneer deze aan de microtubulus bindt, splitst ATP in voet 1 in ADP en Pi (hydrolyse). Fosfaat komt
vrij. Voet 2 laat zijn ADP los en neemt ATP op enzovoort.
Eiwitten zijn onmisbaar
Veel eiwitten zijn essentieel voor het goed laten
functioneren van een cel. Er zijn veel verschillende typen
eiwitten, elk met een eigen functie:
§18.3 - Enzymwerking
Enzymen katalyseren chemische reacties. Zonder
enzymen verlopen chemische reacties te langzaam en
kunnen cellen niet functioneren. Alle enzymen zijn pH-
en temperatuurgevoelig.
Hoe werken enzymen?
Enzymen zijn opgebouwd uit aminozuren. De structuur
bepaalt de ruimtelijke vorm van het enzym. Elk enzym
heeft een andere vorm. Door te binden aan substraatmoleculen, verlagen enzymmoleculen de
activeringsenergie van een reactie. Elk type enzymreactie heeft een eigen optimumtemperatuur. De binding
van een enzymmolecuul aan zijn substraatmolecuul is specifiek. In het sleutel-slotmodel past het
substraatmolecuul op het actieve centrum van het enzym. In het induced-fitmodel verandert het actieve
centrum van een enzymmolecuul als het bindt met een substraatmolecuul. Veel enzymmoleculen bevatten
naast aminozuurmoleculen ook een niet-eitwitdeel; cofactor. De cofactor is nodig voor de binding van het
substraatmolecuul aan het enzymmolecuul. De cofactor kan ook een organisch molecuul zijn: co-enzym.
§18.1 - Van polypeptideketen tot een werkzaam eiwit
Elke cel in je lichaam kan duizenden
verschillende eiwitten vormen. Deze eiwitten
gaan allemaal naar een eigen plaats. Veel
ribosomen koppelen aan het ER, voordat ze de
translatie voltooien. Adreslabels brengen
eiwitten naar de juiste plaats. Dit bindt aan een
signaalherkenningsmolecuul (SHM) uit het
grondplasma. Translatie stopt tijdelijk (binas
71J). Het SHM hect aan een SHM-receptor van
het ER. Het ribosoom koppelt aan een
ribosoomreceptor van het ER. Eitwitpoort
opent. GTP hecht aan de SHM-receptor. Het GTP
splitst in GDP en Pi en het SHM komt los van zijn
receptor. Een enzym verwijdert het adreslabel.
De translatie gaat verder, de groeiende polypeptideketen komt binen het ER. Bij het stopcodon bindt een
ontkoppelingseiwit aan het mRNA en koppelt de polypeptideketen los van het ribosoom. De eiwitpoort sluit. In
het ER begint de omzetting naar een eiwit - de polypetideketen krijgt zijn ruimtelijke eiwitstructuur.
Membraan van het glad ER vormen transportblaasjes die de eiwitten voor afwerking naar het Golgi-systeem
vervoeren.
Bewerking in het Golgi-systeem
In het Golgi-systeem ontstaat de definitieve eiwitvorm. Enzymen voegen
fosfaatgroepen toe, wijzigen de toegevoegde suikers en/of koppelen
meerdere polypeptideketens aaneen tot een eiwit. De gevormde
eiwitmoleculen vormen membraaneiwitten, gaan via exocytose
(transportblaasje) de cel uit of werken als bouwstof of enzym in de cel.
Ruimtelijke structuur
Eiwitten hebben een specifieke ruimtelijke structuur. De
volgorde en het aantal van elk type aminozuur bepalen de
primaire structuur van een eiwitmolecuul. Een α-helix of een
ꞵ-plaat vormt de secundaire structuur. Deze structuur is het
resultaat van waterstofbruggen tussen de N-H groepen en
C=O groepen van verschillende aminozuren in eiwitten. De
tertiaire structuur is de driedimensionale structuur die tot
stand komen via bindingen tussen de restroepen van
verschillende aminozuren, twee of meer polypeptideketens
samen vormen de quaternaire structuur (binas 67H2).
Vouwen en denaturatie van eiwitten
Chaperonne-eiwitten vouwen onjuist gevormde eiwitten.
Denaturatie is het verlies van de ruimtelijke structuur van een
eiwitmolecuul.
, §18.2 - Functies van eiwitten
Plaques zijn ophopingen van eiwitten tussen de hersencellen. Tangles zijn eiwitkluwens binnen de
hersencellen. Beide verstoren de werking van de hersenen met als gevolg symptomen als geheugenverlies,
verwarde gedachten, desoriëntatie en een slecht beoordelingsvermogen (Alzheimer). Hersencellen maken het
eiwitmolecuul APP. Bij de afbraak van verouderd APP kunnen eiwitfragmenten ontstaan die aaneen klonteren
tot plaques. Tangles in de hersencellen ontstaan door het samenklonteren van tau-eiwitten. Bij gezonde cellen
zijn tau-eiwitten oplosbaar en houden het celskelet van hersencellen in stand door microtubuli: vormen de
transportwegen van de cel. Bij Alzheimer zijn de tau-eiwitten gehyperfosforyleerd, waardoor ze onoplosbaar
worden en het transportsysteem ontregeld.
Motoreiwitten
Motoreiwitten vervoeren organellen en blaasjes met
voedingsstoffen langs de microtubuli. Voet 1 van het
motoreiwit bindt aan de microtubulus, laat ADP los en
neemt vervolgens ATP op. Hierdoor slingert voet 2 naar
voren. Wanneer deze aan de microtubulus bindt, splitst ATP in voet 1 in ADP en Pi (hydrolyse). Fosfaat komt
vrij. Voet 2 laat zijn ADP los en neemt ATP op enzovoort.
Eiwitten zijn onmisbaar
Veel eiwitten zijn essentieel voor het goed laten
functioneren van een cel. Er zijn veel verschillende typen
eiwitten, elk met een eigen functie:
§18.3 - Enzymwerking
Enzymen katalyseren chemische reacties. Zonder
enzymen verlopen chemische reacties te langzaam en
kunnen cellen niet functioneren. Alle enzymen zijn pH-
en temperatuurgevoelig.
Hoe werken enzymen?
Enzymen zijn opgebouwd uit aminozuren. De structuur
bepaalt de ruimtelijke vorm van het enzym. Elk enzym
heeft een andere vorm. Door te binden aan substraatmoleculen, verlagen enzymmoleculen de
activeringsenergie van een reactie. Elk type enzymreactie heeft een eigen optimumtemperatuur. De binding
van een enzymmolecuul aan zijn substraatmolecuul is specifiek. In het sleutel-slotmodel past het
substraatmolecuul op het actieve centrum van het enzym. In het induced-fitmodel verandert het actieve
centrum van een enzymmolecuul als het bindt met een substraatmolecuul. Veel enzymmoleculen bevatten
naast aminozuurmoleculen ook een niet-eitwitdeel; cofactor. De cofactor is nodig voor de binding van het
substraatmolecuul aan het enzymmolecuul. De cofactor kan ook een organisch molecuul zijn: co-enzym.