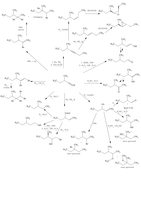
Een base is het deeltje dat dissocieert in water om OH- te geven -> wint een proton nucleofiel
Bronsted- lowry
Hoe groter Ka, hoe kleiner pKa, hoe sterker het zuur.
HCl (zuur) + H20 (base) -> Cl- (geconjugeerd base)+ H3O+ (geconjugeerd zuur)
Factor 1
Hoe groter het molecuul, hoe sterker het zuur. Hoe meer elektronenschillen er zijn, hoe makkelijker
de negatieve lading is te stabiliseren. Hoe stabieler de negatieve lading, hoe sterker het zuur.
Factor 2
Hoe hoger het elektronnegativiteit, hoe sterker het zuur. Het molecuul trekt harder aan het elektron
en is stabieler. Stabieler is sterker. Naar rechts in het periodiek systeem betekend een groter
elektronnegativiteit.
Factor 3
Inductieve elektronen wegtrekking:
Een atoom met een groter elektron negativiteit, trekt harder aan de elektronen daardoor is de
negatieve lading van bv. zuurstof minder groot en is het molecuul stabieler en een sterker zuur.
Factor 4 hybridisatie
SP: drie dubbele binding
SP2: dubbele binding
SP3: enkele binding
Meer s karakter, hoe dichter de elektronen bij de kern komen. Hoe stabieler het molecuul, hoe
sterker het zuur.
Factor 5 Resonantie
Gelokaliseerde elektronen zijn bindingen. Gedelokaliseerde elektronen zijn gedeelde elektronen.
Alleen π elektronen en vrije elektronen paren verplaatsen. Het totaal aantal elektronen veranderd
niet.
Minder stabiel
Onvolledig octet
Gescheiden lading
Negatieve lading niet op het meest elektronegatieve atoom.
Regels voor tekenen pijlen
- Van negatief geladen atoom richting positief
- Geeft de beweging van de elektronen aan. Niet van de atomen.
- Begin van de pijl: waar komt e- vandaan?
- Eind van de pijl: waar gaat de e- naar toe?
- Pijl start bij de bron van e- niet het atoom
Primair, secundair en tertiair
Het nucleofiel is zwakker wanneer deze meer
koolstofbindingen heeft. Een primair molecuul
is een sterker nucleofiel