Samenvatting BCM21 Week 3
Cristy Verzijl
Week 3 Enzymen
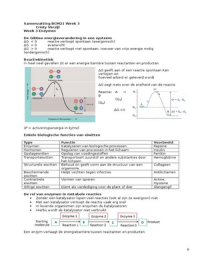
De Gibbse energieverandering in een systeem
ΔG < 0 reactie verloopt spontaan (exergonisch)
ΔG = 0 evenwicht
ΔG > 0 reactie verloopt niet spontaan, toevoer van vrije energie nodig
(endergonisch)
Reactiekinetiek
In heel veel gevallen zit er een energie barrière tussen reactanten en producten
ΔG geeft aan of een reactie spontaan kan
verlopen en
hoeveel arbeid er geleverd wordt
ΔG zegt niets over de snelheid van de reactie
Reactie: A →
B
(Ga)
(Gb)
ΔG <0
G‡ = activeringsenergie in kJ/mol
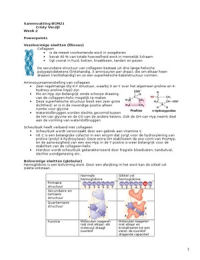
Enkele biologische functies van eiwitten
Type Functie Voorbeeld
Enzymen Katalyseren van biologische processen Pepsine
Hormonen Reguleren van processen in het lichaam Insulin
Opslageiwitten Opslag van voedingsstoffen Ferritin
Transporteiwitten Transporteert zuurstof en andere substanties door Hemoglobine
het lichaam
Structurele eiwitten Behoud en geeft vorm aan de structuur van een Collageen
organisme
Beschermende Helpt vechten tegen infecties Antilichamen
eiwitten
Contractiele Vormen van spieren Actine,
eiwitten myosine
Giftige eiwitten Dient als verdediging voor de plant of dier Slangengif
De rol van enzymen in metabole reacties
Zonder een katalysator lopen veel reacties (ook al zijn ze exergoon) niet
Met een katalysator verloopt de reactie vaak erg snel
In levende organismen zijn enzymen de katalysatoren
Hierbij wordt de katalysator niet verbruikt
Een enzym verlaagt de energiebarrière tussen reactanten en producten
4
, Hoe werkt een enzym
Een enzym bindt een specifiek substraat en zorgt voor een comfortabele pasvorm
voor het transitie stadium.
De binding van enzym aan substraat is exergonisch. De energie die erbij vrijkomt
verlaagt de activeringsenergie voor de reactie en vergroot daarmee de
reactiesnelheid
Bij dezelfde temperatuur hebben meer moleculen voldoende energie dus neemt
de snelheid van omzetting toe
Enzym + Substraat Enzymsubstraatcomplex Enzym + Product
E+S ES E+P
Kenmerken van een enzym
Komt onveranderd uit de reactie
Katalyseert zowel de heen‐ als teruggaande reactie
Beïnvloedt niet de ligging van het evenwicht
De reactie blijft afhankelijk van de temperatuur
De pH en de temperatuur zij van invloed op de enzymatische activiteit.
Substraatbindingsplaats (actief centrum) van het enzym
Het gebied in het enzym waar de katalysatie van de reactie plaatsvindt
Emil Fisher (1894): Sleutel-slot model
Het actief centrum van het enzym is complementair aan het substraat
Polanyi (1921); Haldane (1930) en Pauling (1946)
Het actief centrum is complementair aan het transitie stadium van het substraat
4
Cristy Verzijl
Week 3 Enzymen
De Gibbse energieverandering in een systeem
ΔG < 0 reactie verloopt spontaan (exergonisch)
ΔG = 0 evenwicht
ΔG > 0 reactie verloopt niet spontaan, toevoer van vrije energie nodig
(endergonisch)
Reactiekinetiek
In heel veel gevallen zit er een energie barrière tussen reactanten en producten
ΔG geeft aan of een reactie spontaan kan
verlopen en
hoeveel arbeid er geleverd wordt
ΔG zegt niets over de snelheid van de reactie
Reactie: A →
B
(Ga)
(Gb)
ΔG <0
G‡ = activeringsenergie in kJ/mol
Enkele biologische functies van eiwitten
Type Functie Voorbeeld
Enzymen Katalyseren van biologische processen Pepsine
Hormonen Reguleren van processen in het lichaam Insulin
Opslageiwitten Opslag van voedingsstoffen Ferritin
Transporteiwitten Transporteert zuurstof en andere substanties door Hemoglobine
het lichaam
Structurele eiwitten Behoud en geeft vorm aan de structuur van een Collageen
organisme
Beschermende Helpt vechten tegen infecties Antilichamen
eiwitten
Contractiele Vormen van spieren Actine,
eiwitten myosine
Giftige eiwitten Dient als verdediging voor de plant of dier Slangengif
De rol van enzymen in metabole reacties
Zonder een katalysator lopen veel reacties (ook al zijn ze exergoon) niet
Met een katalysator verloopt de reactie vaak erg snel
In levende organismen zijn enzymen de katalysatoren
Hierbij wordt de katalysator niet verbruikt
Een enzym verlaagt de energiebarrière tussen reactanten en producten
4
, Hoe werkt een enzym
Een enzym bindt een specifiek substraat en zorgt voor een comfortabele pasvorm
voor het transitie stadium.
De binding van enzym aan substraat is exergonisch. De energie die erbij vrijkomt
verlaagt de activeringsenergie voor de reactie en vergroot daarmee de
reactiesnelheid
Bij dezelfde temperatuur hebben meer moleculen voldoende energie dus neemt
de snelheid van omzetting toe
Enzym + Substraat Enzymsubstraatcomplex Enzym + Product
E+S ES E+P
Kenmerken van een enzym
Komt onveranderd uit de reactie
Katalyseert zowel de heen‐ als teruggaande reactie
Beïnvloedt niet de ligging van het evenwicht
De reactie blijft afhankelijk van de temperatuur
De pH en de temperatuur zij van invloed op de enzymatische activiteit.
Substraatbindingsplaats (actief centrum) van het enzym
Het gebied in het enzym waar de katalysatie van de reactie plaatsvindt
Emil Fisher (1894): Sleutel-slot model
Het actief centrum van het enzym is complementair aan het substraat
Polanyi (1921); Haldane (1930) en Pauling (1946)
Het actief centrum is complementair aan het transitie stadium van het substraat
4