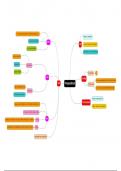
Addition
Die Addition kann als Umkehrung der verstanden werden
Eliminierung
"
:
gut polarisierten F- et
Eliminierung .
machen Alkene ZU Nukleophile
basisch
i
¢¢
r
- -
-
( =
c + H Br -
l d
r
H Br
sauer
Addition
Halogenalkan Alken
Elektrophile Addition AE Von HX
H H
%
'
S
.
ö I wir \
IÜI
④
¥
✓
t H 4
ftp.C-C ,
t
schnell % Cy
- ' -
langsam ,
H
Carbenillmion
EnergieProfit
+ >
geschwindigkeitsbestimmend ThermoChemie :
^
A-
x
E + CP
: !!!
µ
"
""
¥ ⑦ C- H =
98 kcal Imd
- - - - - -
- - - -
H Produkte
THCI ¥Cl ④ C- Cl =
80kcal Imd
>
Reaktions Koordinate I = -
10kcal Imd
>E Wird frei
f- exotherm )
Relative Geschwindigkeiten
°
Nukleophile IT -
Bindung :
je elektronen reicher das Alken ,
desto schneller die AE
•
Stabilität des intermediären carbeniumions
•
Stärke des Elektrophile ( HU , HBR , HI Sind gut ,
HF ZU schwach )
Regioselektiv ität
¥ + Ha '
¥" kund nicht
¥
⑦
te ,
%
¥0 primäres
"
tert.carbehiumiony.tt
'
( INSTABIL ! )
carbenillmion
, > Stabilitäten von Carbeniumionen :
Benzyl =
AHH > tertiär > sekundär 1) primär →
Methyl )
Markovnikov -
Regel :
Bei der Addition von HX an nicht symmetrische Alkene addiert sich Ht
immer an das weniger substituierte c- Atom der
Doppelbindung .
Das höher substituierte
Halogen alkan ist das Hauptprodukt .
Stereochemie
Oberseite
µ 1
TÄTIG }
> v
-0
µ + H -
CI '
E- + Cl '
a :
Racemat
+
Unterseite N 1
:
HX -
Addition an 1,3 -
Diener
+ 2 Ha .
c, ,
knickt :
¥
( ,
^
Baren
×
Fündig
fü
.
Addition
an
Endständige
tertiär -
taktisch
"
¥1
+ v
+ c! ICI Cl
c,
.
^
✓ '
höher substituiert tertiär
Doppelbindung
tttnicht :
¥)
Addition von Br, ich
¥, .
Ei! +
Ei! Kein cis Produkt ! )
-
trans
1 :
1
>
Stereospezifische anti -
Addition
Die Addition kann als Umkehrung der verstanden werden
Eliminierung
"
:
gut polarisierten F- et
Eliminierung .
machen Alkene ZU Nukleophile
basisch
i
¢¢
r
- -
-
( =
c + H Br -
l d
r
H Br
sauer
Addition
Halogenalkan Alken
Elektrophile Addition AE Von HX
H H
%
'
S
.
ö I wir \
IÜI
④
¥
✓
t H 4
ftp.C-C ,
t
schnell % Cy
- ' -
langsam ,
H
Carbenillmion
EnergieProfit
+ >
geschwindigkeitsbestimmend ThermoChemie :
^
A-
x
E + CP
: !!!
µ
"
""
¥ ⑦ C- H =
98 kcal Imd
- - - - - -
- - - -
H Produkte
THCI ¥Cl ④ C- Cl =
80kcal Imd
>
Reaktions Koordinate I = -
10kcal Imd
>E Wird frei
f- exotherm )
Relative Geschwindigkeiten
°
Nukleophile IT -
Bindung :
je elektronen reicher das Alken ,
desto schneller die AE
•
Stabilität des intermediären carbeniumions
•
Stärke des Elektrophile ( HU , HBR , HI Sind gut ,
HF ZU schwach )
Regioselektiv ität
¥ + Ha '
¥" kund nicht
¥
⑦
te ,
%
¥0 primäres
"
tert.carbehiumiony.tt
'
( INSTABIL ! )
carbenillmion
, > Stabilitäten von Carbeniumionen :
Benzyl =
AHH > tertiär > sekundär 1) primär →
Methyl )
Markovnikov -
Regel :
Bei der Addition von HX an nicht symmetrische Alkene addiert sich Ht
immer an das weniger substituierte c- Atom der
Doppelbindung .
Das höher substituierte
Halogen alkan ist das Hauptprodukt .
Stereochemie
Oberseite
µ 1
TÄTIG }
> v
-0
µ + H -
CI '
E- + Cl '
a :
Racemat
+
Unterseite N 1
:
HX -
Addition an 1,3 -
Diener
+ 2 Ha .
c, ,
knickt :
¥
( ,
^
Baren
×
Fündig
fü
.
Addition
an
Endständige
tertiär -
taktisch
"
¥1
+ v
+ c! ICI Cl
c,
.
^
✓ '
höher substituiert tertiär
Doppelbindung
tttnicht :
¥)
Addition von Br, ich
¥, .
Ei! +
Ei! Kein cis Produkt ! )
-
trans
1 :
1
>
Stereospezifische anti -
Addition