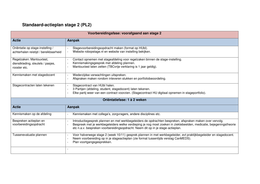
, 1. Hauptsatz der Thermodynamik -
Energieerhaltungssatz
Die Summe aller Energien Systems und ist stets Konstant"
eines seiner
Umgebung
kann weder erschaffen noch verbranntwerden
Energie ARE
->
-
0
=
Energie eines chemischen Systems hängtab von:
Systeme:
Art (chemische
der Stoffe Energiel
·
offenes System -
Stoff-/Energieaustausch
·
Menge der Teilchen (Teilchenzahl)
geschlossenes System -
Energieaustausch
·
Temperatur (thermische Energie) isoliertes System -
kein Austausch
Energieformen:
Chemische
Strahlungsenergie, Thermische Energie, Energie,
Mechanische Energie, Elektrische Energie Umwandlung
-
Änderung der inneren Energie =Arbeit
Summe der Energieformen eines Systems wird als innere Energie u des Systems bezeichnet
Im
geschlossenen System gilt:AU Uc-Un 0 W
=
+
=
Volumenarbeit -
Wu
Wv = -
p. AV Für konstant
p= gilt:Wr--AV da für Gase
gilt:V n .
=
Um
Q AU-Wv = ->
Wv =-
p. An(Gasel. Um ->
AV AnlGasel. Um
=
Volumenarbeit um Volumenarbeitvorherzusagen
Volumenarbeitistextensiv -
molare eher
geeignet, um
Um beziehtsich auf eine
angegebene Reaktionsgleichung:
vA vB + =
vc +
vD
für p=konstant gilt:Wm= -
p. Av(Gase). Um v=Stöchiometriezahl
Reaktionswärme -
Enthalpie (Bei konstantem Druck) 81kcal =
4,184k]
offene Systeme abhängig Stoffmenge
->
von
·>
SV Q-p.
=
Al
a AU p. AV ArH Q Änderung
Art= der Reaktionsenthalpie
=
=
+
ArH SU p. AV =
+
Q rHz
=
-
rH-
H Enthalpie
=
Gröe Bedeutung für negative Werte für positive Werte
Bedeutung
Au Innere
Energie des Systems sinkt Innere Energie des Systems steigt
①, ArH Exotherme Reaktion Endotherme Reaktion
W System verrichtet Arbeit Arbeitwird am System verrichtet
AV Volumenabnahme Volumenzunahme
-
p. AV System verrichtetvolumenarbeit Volumenarbeit wird am System verrichtet
Reaktionsgröen
molar nichtmolar
extensiv
gröer umgesetzte Stoffmengen -intensiv nicht
abhängig Änderungen Gröen
-
je von von
der Edukte, desto gröer Aut im System
->
->
~n r
Bsp.:Masse, Volumen, Entropie, Enthalpie, Teilchenzahl, Bsp.:Druck, Temperatur, Dichte, elektrische Spannung,
elektrische Ladung chem. Potential
Energieerhaltungssatz
Die Summe aller Energien Systems und ist stets Konstant"
eines seiner
Umgebung
kann weder erschaffen noch verbranntwerden
Energie ARE
->
-
0
=
Energie eines chemischen Systems hängtab von:
Systeme:
Art (chemische
der Stoffe Energiel
·
offenes System -
Stoff-/Energieaustausch
·
Menge der Teilchen (Teilchenzahl)
geschlossenes System -
Energieaustausch
·
Temperatur (thermische Energie) isoliertes System -
kein Austausch
Energieformen:
Chemische
Strahlungsenergie, Thermische Energie, Energie,
Mechanische Energie, Elektrische Energie Umwandlung
-
Änderung der inneren Energie =Arbeit
Summe der Energieformen eines Systems wird als innere Energie u des Systems bezeichnet
Im
geschlossenen System gilt:AU Uc-Un 0 W
=
+
=
Volumenarbeit -
Wu
Wv = -
p. AV Für konstant
p= gilt:Wr--AV da für Gase
gilt:V n .
=
Um
Q AU-Wv = ->
Wv =-
p. An(Gasel. Um ->
AV AnlGasel. Um
=
Volumenarbeit um Volumenarbeitvorherzusagen
Volumenarbeitistextensiv -
molare eher
geeignet, um
Um beziehtsich auf eine
angegebene Reaktionsgleichung:
vA vB + =
vc +
vD
für p=konstant gilt:Wm= -
p. Av(Gase). Um v=Stöchiometriezahl
Reaktionswärme -
Enthalpie (Bei konstantem Druck) 81kcal =
4,184k]
offene Systeme abhängig Stoffmenge
->
von
·>
SV Q-p.
=
Al
a AU p. AV ArH Q Änderung
Art= der Reaktionsenthalpie
=
=
+
ArH SU p. AV =
+
Q rHz
=
-
rH-
H Enthalpie
=
Gröe Bedeutung für negative Werte für positive Werte
Bedeutung
Au Innere
Energie des Systems sinkt Innere Energie des Systems steigt
①, ArH Exotherme Reaktion Endotherme Reaktion
W System verrichtet Arbeit Arbeitwird am System verrichtet
AV Volumenabnahme Volumenzunahme
-
p. AV System verrichtetvolumenarbeit Volumenarbeit wird am System verrichtet
Reaktionsgröen
molar nichtmolar
extensiv
gröer umgesetzte Stoffmengen -intensiv nicht
abhängig Änderungen Gröen
-
je von von
der Edukte, desto gröer Aut im System
->
->
~n r
Bsp.:Masse, Volumen, Entropie, Enthalpie, Teilchenzahl, Bsp.:Druck, Temperatur, Dichte, elektrische Spannung,
elektrische Ladung chem. Potential