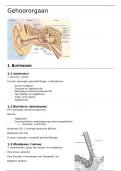
Samenvatting Scheikunde H12 Materialen
12.1: materiaaleigenschappen
Een materiaal kun je op verschillende manieren beschrijven. Als je kijkt
naar waarneembare en meetbare eigenschappen (geur, kookpunt, etc.),
beschrijf je het op macroniveau. Een beschrijving op microniveau
(deeltjesniveau) gebruikt begrippen als moleculen, atomen, ionen en
bindingen. De manier waarop deeltjes in grotere structuren worden
geordend ten opzichte van elkaar, kan ook invloed hebben op de
eigenschappen. Dit is het mesoniveau en voorbeelden hiervan zijn
kristalstructuren of vezelstructuren.
Goed materiaalgebruik is erg belangrijk. Sommige voorwerpen moeten
waterafstotend zijn en anderen mogen niet breekbaar zijn. Belangrijke
materiaaleigenschappen zijn:
Smeltpunt en kookpunt Zuivere stoffen hebben een vast smelt- en
kookpunt, dat afhangt van de sterkte van de bindingen: sterke metaal-
en ionbindingen geven een hoog smelt- en kookpunt, terwijl
moleculaire stoffen lagere waarden hebben, tenzij er waterstofbruggen
aanwezig zijn of de moleculen een groot contactoppervlak hebben. Bij
een zuivere stof laten de moleculen elkaar allemaal bij dezelfde
temperatuur los en blijft de temperatuur constant. Mengsels hebben
geen vast smelt- of kookpunt, omdat de deeltjes verschillende
bindingen en energieën hebben. Er is hier sprake van een smelt- of
kooktraject, waarbij het rond het laagste kookpunt begint en bij het
hoogste kookpunt eindigt.
Geleidend vermogen Een stof kan elektrische stroom geleiden als
er vrij bewegende geladen deeltjes aanwezig zijn. Hoe makkelijker deze
deeltjes kunnen verplaatsen, hoe beter de stroomgeleiding. Metalen
geleiden stroom door vrij bewegende elektronen en opgeloste of
gesmolten zouten door de ionen die vrij kunnen bewegen. Moleculaire
stoffen geleiden meestal niet, behalve bij zuren (die ionen vormen in
water) of speciale materialen waar vrije elektronen aanwezig zijn die
niet vastzitten in een atoombinding.
Oplosbaarheid en waterbindend vermogen Een stof kan in
water oplossen als de waterstofbrug tussen watermoleculen verbroken
kan worden en er nieuwe bindingen ontstaan. Moleculaire stoffen met
een -OH, -NH of C=O-groep lossen goed op in water, doordat ze een H-
brug vormen met water. Moleculaire stoffen met een groot
dipoolmoment lossen vaak ook redelijk goed op. Hydrofobe stoffen
lossen niet op in water, want ze kunnen geen waterstofbrug vormen.
Stoffen met een hydrofiel en een hydrofoob deel, lossen slecht op in
water als het hydrofobe deel groter is dan het hydrofiele.
Macromoleculen (zoals katoen) lossen niet op, maar kunnen wel water
binden doordat ze veel groepen hebben die waterstofbruggen vormen.
Dit komt doordat de ketens zó groot en sterk met elkaar verbonden zijn,
dat ze niet uit elkaar gaan in losse moleculen.
, Vervormbaarheid, brosheid en hardheid hoe sterker de binding,
hoe meer kracht er nodig is om het materiaal te vervormen, en hoe
groter de hardheid. Metalen zijn vervormbaar doordat bij het vervormen
in het metaalrooster de rijen opschuiven zonder dat de metaalbinding
breekt. Zouten zijn niet vervormbaar doordat bij een verschuiving in het
ionrooster, gelijke ladingen naast elkaar staan en het materiaal breekt.
De vervormbaarheid, brosheid en hardheid van een deeltje hangen dus
samen met het rooster en de bindingssterkte.
Chemische reactiviteit de mate waarin materialen chemisch
worden aangetast onder invloed van de omgeving, heet de
corrosiegevoeligheid. Onedele metalen reageren bijvoorbeeld sneller
met water en zuurstof dan edele metalen, en moet je daarom
beschermen met een laklaag. Ook kan het onedele metaal zelf een
beschermend oxidelaagje creëren waardoor het ook niet verder zal
roesten. Wanneer er een dubbele binding in een moleculaire stof
aanwezig is, veroorzaakt dit uv-lichtgevoeligheid. Onder invloed van uv-
licht breken dubbele bindingen namelijk open, waarbij radicalen
ontstaan en nieuwe bindingen gevormd kunnen worden. Een
organische stof die gemakkelijk met zuurstof reageert, heeft een hoge
brandbaarheid. Niet alle organische stoffen ontbranden even
gemakkelijk als het in brand steken. De activeringsenergie is dan
namelijk lager, waardoor de moleculen al bij een lagere temperatuur
genoeg snelheid hebben om met zuurstofmoleculen te botsen.
Kunststoffen bestaan uit lange polymeerketens. Door het grote
contactoppervlak tussen de ketens zijn de vanderwaalsbindingen sterk,
waardoor kunststoffen vast zijn bij kamertemperatuur maar bij verhitting
vervormbaar en licht, maar toch redelijk sterk. De eigenschappen van
kunststoffen kunnen worden beïnvloed door:
Ketenlengte molecuulmassa groter en contactoppervlak groter.
Mesostructuur Polymeerketens kunnen amorf (kriskras) of
kristallijn (netjes naast elkaar) liggen. In
kristallijne structuren liggen ketens dichter bij
elkaar, waardoor vanderwaalsbindingen sterker
en het materiaal harder zijn.
Speciale zijgroepen bindingen tussen
polymeerketens worden sterker, waardoor het kunststof sterker is.
Als stoffen homogene mengsels vormen, bevinden de stoffen zich in
dezelfde fase. Er is dan geen grensvlak tussen de stoffen en de mengsels
zijn helder en doorzichtig. Een voorbeeld is een oplossing, een stof
opgelost in een vloeistof. De moleculen of ionen van de opgeloste stof zijn
volledig van elkaar gescheiden en worden omringd door moleculen van
het oplosmiddel.
Er zijn ook heterogene mengsels, zoals rook (brokjes vaste stof in gas)
of suspensies (brokjes vaste stof in vloeistof). De brokjes bestaan uit veel
moleculen of ionen en na een tijd zakken ze naar de bodem. Deze
12.1: materiaaleigenschappen
Een materiaal kun je op verschillende manieren beschrijven. Als je kijkt
naar waarneembare en meetbare eigenschappen (geur, kookpunt, etc.),
beschrijf je het op macroniveau. Een beschrijving op microniveau
(deeltjesniveau) gebruikt begrippen als moleculen, atomen, ionen en
bindingen. De manier waarop deeltjes in grotere structuren worden
geordend ten opzichte van elkaar, kan ook invloed hebben op de
eigenschappen. Dit is het mesoniveau en voorbeelden hiervan zijn
kristalstructuren of vezelstructuren.
Goed materiaalgebruik is erg belangrijk. Sommige voorwerpen moeten
waterafstotend zijn en anderen mogen niet breekbaar zijn. Belangrijke
materiaaleigenschappen zijn:
Smeltpunt en kookpunt Zuivere stoffen hebben een vast smelt- en
kookpunt, dat afhangt van de sterkte van de bindingen: sterke metaal-
en ionbindingen geven een hoog smelt- en kookpunt, terwijl
moleculaire stoffen lagere waarden hebben, tenzij er waterstofbruggen
aanwezig zijn of de moleculen een groot contactoppervlak hebben. Bij
een zuivere stof laten de moleculen elkaar allemaal bij dezelfde
temperatuur los en blijft de temperatuur constant. Mengsels hebben
geen vast smelt- of kookpunt, omdat de deeltjes verschillende
bindingen en energieën hebben. Er is hier sprake van een smelt- of
kooktraject, waarbij het rond het laagste kookpunt begint en bij het
hoogste kookpunt eindigt.
Geleidend vermogen Een stof kan elektrische stroom geleiden als
er vrij bewegende geladen deeltjes aanwezig zijn. Hoe makkelijker deze
deeltjes kunnen verplaatsen, hoe beter de stroomgeleiding. Metalen
geleiden stroom door vrij bewegende elektronen en opgeloste of
gesmolten zouten door de ionen die vrij kunnen bewegen. Moleculaire
stoffen geleiden meestal niet, behalve bij zuren (die ionen vormen in
water) of speciale materialen waar vrije elektronen aanwezig zijn die
niet vastzitten in een atoombinding.
Oplosbaarheid en waterbindend vermogen Een stof kan in
water oplossen als de waterstofbrug tussen watermoleculen verbroken
kan worden en er nieuwe bindingen ontstaan. Moleculaire stoffen met
een -OH, -NH of C=O-groep lossen goed op in water, doordat ze een H-
brug vormen met water. Moleculaire stoffen met een groot
dipoolmoment lossen vaak ook redelijk goed op. Hydrofobe stoffen
lossen niet op in water, want ze kunnen geen waterstofbrug vormen.
Stoffen met een hydrofiel en een hydrofoob deel, lossen slecht op in
water als het hydrofobe deel groter is dan het hydrofiele.
Macromoleculen (zoals katoen) lossen niet op, maar kunnen wel water
binden doordat ze veel groepen hebben die waterstofbruggen vormen.
Dit komt doordat de ketens zó groot en sterk met elkaar verbonden zijn,
dat ze niet uit elkaar gaan in losse moleculen.
, Vervormbaarheid, brosheid en hardheid hoe sterker de binding,
hoe meer kracht er nodig is om het materiaal te vervormen, en hoe
groter de hardheid. Metalen zijn vervormbaar doordat bij het vervormen
in het metaalrooster de rijen opschuiven zonder dat de metaalbinding
breekt. Zouten zijn niet vervormbaar doordat bij een verschuiving in het
ionrooster, gelijke ladingen naast elkaar staan en het materiaal breekt.
De vervormbaarheid, brosheid en hardheid van een deeltje hangen dus
samen met het rooster en de bindingssterkte.
Chemische reactiviteit de mate waarin materialen chemisch
worden aangetast onder invloed van de omgeving, heet de
corrosiegevoeligheid. Onedele metalen reageren bijvoorbeeld sneller
met water en zuurstof dan edele metalen, en moet je daarom
beschermen met een laklaag. Ook kan het onedele metaal zelf een
beschermend oxidelaagje creëren waardoor het ook niet verder zal
roesten. Wanneer er een dubbele binding in een moleculaire stof
aanwezig is, veroorzaakt dit uv-lichtgevoeligheid. Onder invloed van uv-
licht breken dubbele bindingen namelijk open, waarbij radicalen
ontstaan en nieuwe bindingen gevormd kunnen worden. Een
organische stof die gemakkelijk met zuurstof reageert, heeft een hoge
brandbaarheid. Niet alle organische stoffen ontbranden even
gemakkelijk als het in brand steken. De activeringsenergie is dan
namelijk lager, waardoor de moleculen al bij een lagere temperatuur
genoeg snelheid hebben om met zuurstofmoleculen te botsen.
Kunststoffen bestaan uit lange polymeerketens. Door het grote
contactoppervlak tussen de ketens zijn de vanderwaalsbindingen sterk,
waardoor kunststoffen vast zijn bij kamertemperatuur maar bij verhitting
vervormbaar en licht, maar toch redelijk sterk. De eigenschappen van
kunststoffen kunnen worden beïnvloed door:
Ketenlengte molecuulmassa groter en contactoppervlak groter.
Mesostructuur Polymeerketens kunnen amorf (kriskras) of
kristallijn (netjes naast elkaar) liggen. In
kristallijne structuren liggen ketens dichter bij
elkaar, waardoor vanderwaalsbindingen sterker
en het materiaal harder zijn.
Speciale zijgroepen bindingen tussen
polymeerketens worden sterker, waardoor het kunststof sterker is.
Als stoffen homogene mengsels vormen, bevinden de stoffen zich in
dezelfde fase. Er is dan geen grensvlak tussen de stoffen en de mengsels
zijn helder en doorzichtig. Een voorbeeld is een oplossing, een stof
opgelost in een vloeistof. De moleculen of ionen van de opgeloste stof zijn
volledig van elkaar gescheiden en worden omringd door moleculen van
het oplosmiddel.
Er zijn ook heterogene mengsels, zoals rook (brokjes vaste stof in gas)
of suspensies (brokjes vaste stof in vloeistof). De brokjes bestaan uit veel
moleculen of ionen en na een tijd zakken ze naar de bodem. Deze