Unit 13A by
Unit 13A
Task 1
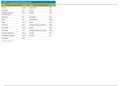
pH of half-neutralised ethanoic 3.9
acid solution (1st run)
Average pH value
pH of half-neutralised ethanoic 3.9
acid solution (2nd run)
pH of half-neutralised ethanoic 3.9
acid solution
Average pH Value 3.9
Trial run 1st run 2nd Run
Initial reading / 0.00 0.00 0.00
cm30.00
Final reading / cm3 23.00 23.50 22.50
Titre (volume used) 23.00 23.50 22.50
/ cm 3
Mean titre (V) / cm3 22.50
V/2 / cm 11.25
PKA calculations:
Ka= [CH3COOH] [H+]/[CH3COOH]
Ka=10^pH
Ka=10^-3.9
Ethanoic Acid: Ka= 1.26 X10^-4 molmd^-3
PKa =-log10Ka
PKa= -log10[1.26 x 10^-5]
, Unit 13A by
PKa= 4.80
Comparison of the theoretical vs actual values
The published Ka value for ethanoic acid is 1.8 x 10^-5 , however our calculated Ka
value is 1.59 x 10^-5. This quite close to the published Ka value considering we didn't
have a professional lab to complete the titration in. PH metres and equipment not being
calibrated may have affected the titration errors. As our experiment was done in a
classroom my result was affected by human errors, equipment precision, environmental
factors, and impurities. My value was close, but slight errors made it less accurate. If the
color change was not observed precisely at the equivalence point, this may have lead to
incorrect pH readings. The acid concentration may differ somewhat from the estimated
value if the solutions were not entirely pure. The pH can be slightly changed when
carbon dioxide from the air dissolves in water and forms carbonic acid. Ethanoic acid
dissociation may be impacted if the experiment's temperature deviated from
conventional settings, which are 25°C. An erroneous reading could have resulted from
inadequate mixing of the solutions. In summary although there are things we couldve
done to get close the published Ka measurement , our classroom value will never be
the same because of the many things that lead to slight inaccuracies.
Buffer solution
Addition of HCl pH Addition of NaOH pH
volume volume
1cm3 3.8 1cm3 3.8
2cm3 3.8 2cm3 3.8
3cm3 3.8 3cm3 3.8
4cm3 3.7 4cm3 3.8
5cm3 3.7 5cm3 3.8
6cm3 3.7 6cm3 3.8
Calculations:
Unit 13A
Task 1
pH of half-neutralised ethanoic 3.9
acid solution (1st run)
Average pH value
pH of half-neutralised ethanoic 3.9
acid solution (2nd run)
pH of half-neutralised ethanoic 3.9
acid solution
Average pH Value 3.9
Trial run 1st run 2nd Run
Initial reading / 0.00 0.00 0.00
cm30.00
Final reading / cm3 23.00 23.50 22.50
Titre (volume used) 23.00 23.50 22.50
/ cm 3
Mean titre (V) / cm3 22.50
V/2 / cm 11.25
PKA calculations:
Ka= [CH3COOH] [H+]/[CH3COOH]
Ka=10^pH
Ka=10^-3.9
Ethanoic Acid: Ka= 1.26 X10^-4 molmd^-3
PKa =-log10Ka
PKa= -log10[1.26 x 10^-5]
, Unit 13A by
PKa= 4.80
Comparison of the theoretical vs actual values
The published Ka value for ethanoic acid is 1.8 x 10^-5 , however our calculated Ka
value is 1.59 x 10^-5. This quite close to the published Ka value considering we didn't
have a professional lab to complete the titration in. PH metres and equipment not being
calibrated may have affected the titration errors. As our experiment was done in a
classroom my result was affected by human errors, equipment precision, environmental
factors, and impurities. My value was close, but slight errors made it less accurate. If the
color change was not observed precisely at the equivalence point, this may have lead to
incorrect pH readings. The acid concentration may differ somewhat from the estimated
value if the solutions were not entirely pure. The pH can be slightly changed when
carbon dioxide from the air dissolves in water and forms carbonic acid. Ethanoic acid
dissociation may be impacted if the experiment's temperature deviated from
conventional settings, which are 25°C. An erroneous reading could have resulted from
inadequate mixing of the solutions. In summary although there are things we couldve
done to get close the published Ka measurement , our classroom value will never be
the same because of the many things that lead to slight inaccuracies.
Buffer solution
Addition of HCl pH Addition of NaOH pH
volume volume
1cm3 3.8 1cm3 3.8
2cm3 3.8 2cm3 3.8
3cm3 3.8 3cm3 3.8
4cm3 3.7 4cm3 3.8
5cm3 3.7 5cm3 3.8
6cm3 3.7 6cm3 3.8
Calculations: