Chemie Overal
Hoofdstuk 18 Accu’s en brandstofcellen:
Elektrochemische cel: cellen die chemische energie omzetten in elektrische energie via
redoxreacties. In de afbeelding rechts is een opgezette elektrochemische cel te zien.
Halfcellen: reactievaten waar de
halfreacties los van elkaar plaatsvinden.
De halfcellen zijn verbonden aan elkaar
met een stroomdraad en een zoutbrug
voor een gesloten stroomkring. In de
zoutbrug zit een elektrolyt opgelost. De
elektrolyt zorgt voor stroomgeleiding. Aan
de stroomdraad zit in de halfcel een
elektrode. De elektroden bevatten de
oxidator en reductor. De elektrode met de oxidator heet de cathode en de elektrode met de
reductor heet de anode. De cathode is positief en de anode is negatief, waardoor de
elektronen gaan verplaatsen.
Bronspanning: spanning die nodig is voor elektrische apparaten. Dit is hetzelfde als het
∆standaardelektrodepotentiaal:
∆V0 = V0(ox) – V0(red).
De elektrodepotentialen zijn terug te vinden in Binas tabel 48.
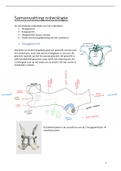
Een batterij is een elektrochemische cel. In het voorbeeld
hiernaast zie je hoe een batterij er uit ziet. C is hier de
cathode en dus de oxidator, Zn is de anode en dus de
reductor. De vochtige pasta is de elektrolyt.
Een oplaadbare batterij wordt opgeladen via elektrolyse.
De halfreacties vinden dan omgekeerd plaats. Wat nu de
reductor is, is normaal (bij levering van stroom) de oxidator
en andersom.
Een brandstofcel is een elektrochemische cel waarbij
zuurstof de oxidator is die continu wordt toegevoegd.
De reductor is een brandstof. De totaalvergelijking van
een brandstofcel is vaak gewoon een
verbrandingsreactie. Hier zie je een voorbeeld van een
brandstofcel. De brandstof is waterstof en de oxidator
dus zuurstof. De totaalreactie is 2 H2 + O2 → 2 H2O,