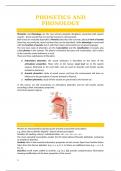
H1 Atoombouw
1.1 Atoommodel
Een atoom bestaat uit een kern met protonen en neutronen. Daaromheen bevinden zich
elektronen die in banen om de kern bewegen. Protonen zijn positief en elektronen zijn
negatief geladen. Neutronen zijn ongeladen (nul). Het atoomnummer geeft het aantal
protonen in een atoom weer. Het aantal elektronen is gelijk aan het aantal protonen, omdat
een atoom elektrisch neutraal is. Massagetal= het aantal protonen + het aantal
neutronen
Isotopen zijn atomen met hetzelfde aantal protonen maar een ander aantal neutronen.
Verschillende manieren hoe je een bepaald massagetal kan weergeven
1.2 Periodiek systeem
Het periodiek systeem bestaat uit groepen (verticale kolommen) en perioden (horizontale
lijn). De elementen staan gerangschikt naar oplopend atoomnummer (bijv. 19,20,21 enz.)
Elementen uit dezelfde groep hebben vaak overeenkomstige chemische eigenschappen.
Groep 1: alkalimetalen, groep 2: aardalkalimetalen ; groep 17: halogenen ; groep 18
edelgassen. Elementen met een atoomnummer groter dan 92 zijn synthetische (niet-
natuurlijke) elementen.
1.3 Atoommassa en molecuulmassa
De atoommassa wordt bepaald door de massa van de protonen en neutronen in het atoom.
De gemiddelde atoommassa wordt bepaald door de in de natuur voorkomende isotopen van
het element. De relatieve atoommassa Ar is gelijk aan de gemiddelde atoommassa , maar
heeft geen eenheid. De molecuulmassa is de som van de massa van alle atomen in een
molecuul.
1.1 Atoommodel
Een atoom bestaat uit een kern met protonen en neutronen. Daaromheen bevinden zich
elektronen die in banen om de kern bewegen. Protonen zijn positief en elektronen zijn
negatief geladen. Neutronen zijn ongeladen (nul). Het atoomnummer geeft het aantal
protonen in een atoom weer. Het aantal elektronen is gelijk aan het aantal protonen, omdat
een atoom elektrisch neutraal is. Massagetal= het aantal protonen + het aantal
neutronen
Isotopen zijn atomen met hetzelfde aantal protonen maar een ander aantal neutronen.
Verschillende manieren hoe je een bepaald massagetal kan weergeven
1.2 Periodiek systeem
Het periodiek systeem bestaat uit groepen (verticale kolommen) en perioden (horizontale
lijn). De elementen staan gerangschikt naar oplopend atoomnummer (bijv. 19,20,21 enz.)
Elementen uit dezelfde groep hebben vaak overeenkomstige chemische eigenschappen.
Groep 1: alkalimetalen, groep 2: aardalkalimetalen ; groep 17: halogenen ; groep 18
edelgassen. Elementen met een atoomnummer groter dan 92 zijn synthetische (niet-
natuurlijke) elementen.
1.3 Atoommassa en molecuulmassa
De atoommassa wordt bepaald door de massa van de protonen en neutronen in het atoom.
De gemiddelde atoommassa wordt bepaald door de in de natuur voorkomende isotopen van
het element. De relatieve atoommassa Ar is gelijk aan de gemiddelde atoommassa , maar
heeft geen eenheid. De molecuulmassa is de som van de massa van alle atomen in een
molecuul.