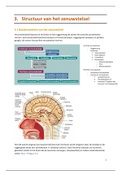
REACTIES VAN ALKENEN
ADDITIE HX (HALOGEENWATERSTOF) AAN EEN ALKEEN
° halogeenalkaan
Stap 1: traag
Elektronenpaar π binding wordt
aangetrokken door partieel positieve H
(elektrofiel)
H – Br binding breekt, Br houdt
elektronenpaar en wordt negatief geladen
° σ binding tussen C en H, andere C wordt
positief
Stap 2: snel
Elektronenpaar negatieve Br (nucleofiel) valt
aan op positieve C
⚠️Additie elektrofiel aan 1 sp2 C en additie nucleofiel aan andere sp 2 C-atoom
⚠️Elektrofiel en nucleofiel bepalen welk alkeen het uiteindelijk wordt
Symmetrisch alkeen Assymetrisch alkeen
Maakt niet uit op welke C het H-atoom 2 sp2 C-atomen hebben verschillende
komt, of op welke C de X komt substituenten
Beide uitkomsten zijn Meerdere mogelijkheden:
identiek na rotatie structuurisomeren
Hoe stabieler uitkomst (lagere Ea),
hoe waarschijnlijker dat deze
gevormd zal worden
STABILITEIT CARBOKATION
Stabiel carbokation, zorgt voor stabiel eindproduct lagere energie
Meest stabiel tertiair carbokation > secundair > primair minst stabiel
Hoe meer alkylsubstituenten op positieve C, hoe stabieler carbokation
stabiliseren positieve lading, vangen elektronen te kort op
Stabiel carbokation lagere Ea makkelijker gevormd
INDUCTIEF EFFECT
Verschuiving van elektronen in een molecule als gevolg van
elektronegativiteitsverschillen
, Alkylgroepen zijn inductief duwende groepen die de positieve lading
stabiliseren
HYPERCONJUGATIE
Stabiliseren door delokalisatie van e- uit naburige bindingen naar het lege p-
orbitaal op de positieve C
Naburige alkylgroep met C – H binding parallel met leeg p-orbitaal
stabiliseert
Positieve lading wordt verspreidt over meerdere atomen
Delokalisatie elektronen door overlap tussen leeg p-orbitaal positieve C en
gevuld sp3 orbitaal (C – H binding) van alkylgroep ALS ze parallel staan met
elkaar
⚠️Enkel mogelijk als substituent alkylgroep is, anders staan ze niet parallel
Methylkation GEEN hyperconjugatie: p-orbitaal ⊥ 3 overige C – H
orbitalen
⚠️Hyperconjugatie als sigma binding heeft zelfde oriëntatie als p-orbitaal OF kan
juiste oriëntatie aannemen door rotatie rond C – C sigma binding
STRUCTUUR TRANSITIETOESTAND
Stabiliteit transitietoestand zorgt dat “bergje”/E a lager is, de reactie sneller
verloopt
TTS neemt verschillende vormen aan
A en B dicht bij elkaar, nog ver van C
A , B en C even ver van elkaar
B en C dicht bij elkaar, ver van A
Postulaat van Hammond: TTS lijkt structureel het meest
op het species dat energetisch het dichts bij ligt
Exo-energetisch: TTS dicht bij reagens (I)
Endo-energetisch: TTS dicht bij product (III)
⚠️Bij endo-energetische reactie dat carbokation vormt: zaken
die carbokation stabiliseren, stabiliseren TTS ook
REGIOSELECTIVITEIT
Volledig regioselectief: 1 reactieproduct
Groot verschil in Ea tussen 2 carbokations waardoor enkel stabielste vormd wordt
gevormd
Regioselectief: 2 reactieproducten 1 hoofdproduct en 1 nevenproduct
Klein verschil in Ea waardoor beiden worden gevormd maar stabielste het meest
Niet-regioselectief: 2 reactieproducten die evenveel aanwezig zijn
Beide vormen zijn even stabiel en worden evenveel gevormd
ADDITIE HX (HALOGEENWATERSTOF) AAN EEN ALKEEN
° halogeenalkaan
Stap 1: traag
Elektronenpaar π binding wordt
aangetrokken door partieel positieve H
(elektrofiel)
H – Br binding breekt, Br houdt
elektronenpaar en wordt negatief geladen
° σ binding tussen C en H, andere C wordt
positief
Stap 2: snel
Elektronenpaar negatieve Br (nucleofiel) valt
aan op positieve C
⚠️Additie elektrofiel aan 1 sp2 C en additie nucleofiel aan andere sp 2 C-atoom
⚠️Elektrofiel en nucleofiel bepalen welk alkeen het uiteindelijk wordt
Symmetrisch alkeen Assymetrisch alkeen
Maakt niet uit op welke C het H-atoom 2 sp2 C-atomen hebben verschillende
komt, of op welke C de X komt substituenten
Beide uitkomsten zijn Meerdere mogelijkheden:
identiek na rotatie structuurisomeren
Hoe stabieler uitkomst (lagere Ea),
hoe waarschijnlijker dat deze
gevormd zal worden
STABILITEIT CARBOKATION
Stabiel carbokation, zorgt voor stabiel eindproduct lagere energie
Meest stabiel tertiair carbokation > secundair > primair minst stabiel
Hoe meer alkylsubstituenten op positieve C, hoe stabieler carbokation
stabiliseren positieve lading, vangen elektronen te kort op
Stabiel carbokation lagere Ea makkelijker gevormd
INDUCTIEF EFFECT
Verschuiving van elektronen in een molecule als gevolg van
elektronegativiteitsverschillen
, Alkylgroepen zijn inductief duwende groepen die de positieve lading
stabiliseren
HYPERCONJUGATIE
Stabiliseren door delokalisatie van e- uit naburige bindingen naar het lege p-
orbitaal op de positieve C
Naburige alkylgroep met C – H binding parallel met leeg p-orbitaal
stabiliseert
Positieve lading wordt verspreidt over meerdere atomen
Delokalisatie elektronen door overlap tussen leeg p-orbitaal positieve C en
gevuld sp3 orbitaal (C – H binding) van alkylgroep ALS ze parallel staan met
elkaar
⚠️Enkel mogelijk als substituent alkylgroep is, anders staan ze niet parallel
Methylkation GEEN hyperconjugatie: p-orbitaal ⊥ 3 overige C – H
orbitalen
⚠️Hyperconjugatie als sigma binding heeft zelfde oriëntatie als p-orbitaal OF kan
juiste oriëntatie aannemen door rotatie rond C – C sigma binding
STRUCTUUR TRANSITIETOESTAND
Stabiliteit transitietoestand zorgt dat “bergje”/E a lager is, de reactie sneller
verloopt
TTS neemt verschillende vormen aan
A en B dicht bij elkaar, nog ver van C
A , B en C even ver van elkaar
B en C dicht bij elkaar, ver van A
Postulaat van Hammond: TTS lijkt structureel het meest
op het species dat energetisch het dichts bij ligt
Exo-energetisch: TTS dicht bij reagens (I)
Endo-energetisch: TTS dicht bij product (III)
⚠️Bij endo-energetische reactie dat carbokation vormt: zaken
die carbokation stabiliseren, stabiliseren TTS ook
REGIOSELECTIVITEIT
Volledig regioselectief: 1 reactieproduct
Groot verschil in Ea tussen 2 carbokations waardoor enkel stabielste vormd wordt
gevormd
Regioselectief: 2 reactieproducten 1 hoofdproduct en 1 nevenproduct
Klein verschil in Ea waardoor beiden worden gevormd maar stabielste het meest
Niet-regioselectief: 2 reactieproducten die evenveel aanwezig zijn
Beide vormen zijn even stabiel en worden evenveel gevormd