Hoofdstuk 2 – Bouwstenen van stoffen
Paragraaf 1
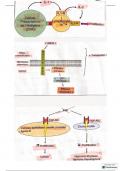
Rutherford heeft het atoommodel geformuleerd waarbij een atoom bestaat uit een positief geladen
atoomkern en daaromheen bewegende negatief geladen elektronen in een elektronenwolk. De kern
bestaat uit protonen en neutronen.
Het atoomnummer is het aantal protonen. Omdat het aantal protonen gelijk is aan het aantal
elektronen is het ook het aantal elektronen. Het aantal protonen bepaalt de stofeigenschappen van
de stof.
Het aantal neutronen in een atoomkern is soms gelijk aan het aantal protonen, maar meestal is het
(iets) groter. De massa van een atoom bestaat uit de som van de protonen en neutronen, omdat de
massa van elektronen zo klein is dat we het verwaarlozen. Het massagetal is de massa van het
atoom.
Isotopen zijn atomen met een afwijkend aantal neutronen. Daardoor verandert het massagetal.
Isotopen geven we weer met het symbool, een streepje, en het massagetal. Het massagetal is het
totaal aantal kerndeeltjes, maar wel een getal zonder eenheid.
Elektronen, protonen en neutronen hebben ook een lading. De eenheid van lading is de coulomb (C).
De elementaire ladingseenheid e komt overeen met 1,6 x 10^-19 coulomb. Een proton heeft de
lading van +1e, een neutron is neutraal en een elektron heeft een lading van –1e.
Bohr verfijnde het model van Rutherford door de elektronenschillen te introduceren. De
elektronenconfiguratie is de verdeling van de elektronen over de schillen.
In het periodiek systeem zijn alle atomen gesorteerd in groepen en perioden gebaseerd op het
atoomnummer en de stofeigenschappen. Sommige groepen hebben speciale namen:
Groep 1 = de alkalimetalen
Groep 2 = de aardalkalimetalen
Groep 17 = de halogenen
Groep 18 = de edelgassen
Paragraaf 2
Atomen kunnen een of meerdere elektronen opnemen of afstaan. Een atoom dat een of meer
elektronen extra of minder heeft, is een ion. Een ion heeft altijd een negatieve of positieve lading.
Dat een atoom elektronen opneemt of afstaat is te verklaren met de octetregel. Atomen streven
naar acht elektronen in de buitenste schil, en als dat lukt zijn ze een ion. De elektronen in de
buitenste schil zijn valentie-elektronen. Valentie-elektronen bepalen dus hoeveel elektronen er
worden opgenomen of afgestaan.
Paragraaf 1
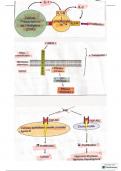
Rutherford heeft het atoommodel geformuleerd waarbij een atoom bestaat uit een positief geladen
atoomkern en daaromheen bewegende negatief geladen elektronen in een elektronenwolk. De kern
bestaat uit protonen en neutronen.
Het atoomnummer is het aantal protonen. Omdat het aantal protonen gelijk is aan het aantal
elektronen is het ook het aantal elektronen. Het aantal protonen bepaalt de stofeigenschappen van
de stof.
Het aantal neutronen in een atoomkern is soms gelijk aan het aantal protonen, maar meestal is het
(iets) groter. De massa van een atoom bestaat uit de som van de protonen en neutronen, omdat de
massa van elektronen zo klein is dat we het verwaarlozen. Het massagetal is de massa van het
atoom.
Isotopen zijn atomen met een afwijkend aantal neutronen. Daardoor verandert het massagetal.
Isotopen geven we weer met het symbool, een streepje, en het massagetal. Het massagetal is het
totaal aantal kerndeeltjes, maar wel een getal zonder eenheid.
Elektronen, protonen en neutronen hebben ook een lading. De eenheid van lading is de coulomb (C).
De elementaire ladingseenheid e komt overeen met 1,6 x 10^-19 coulomb. Een proton heeft de
lading van +1e, een neutron is neutraal en een elektron heeft een lading van –1e.
Bohr verfijnde het model van Rutherford door de elektronenschillen te introduceren. De
elektronenconfiguratie is de verdeling van de elektronen over de schillen.
In het periodiek systeem zijn alle atomen gesorteerd in groepen en perioden gebaseerd op het
atoomnummer en de stofeigenschappen. Sommige groepen hebben speciale namen:
Groep 1 = de alkalimetalen
Groep 2 = de aardalkalimetalen
Groep 17 = de halogenen
Groep 18 = de edelgassen
Paragraaf 2
Atomen kunnen een of meerdere elektronen opnemen of afstaan. Een atoom dat een of meer
elektronen extra of minder heeft, is een ion. Een ion heeft altijd een negatieve of positieve lading.
Dat een atoom elektronen opneemt of afstaat is te verklaren met de octetregel. Atomen streven
naar acht elektronen in de buitenste schil, en als dat lukt zijn ze een ion. De elektronen in de
buitenste schil zijn valentie-elektronen. Valentie-elektronen bepalen dus hoeveel elektronen er
worden opgenomen of afgestaan.