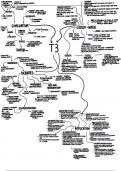
Cel II: Structuur en functies: Biochemie
Waarom biochemie geneeskunde/tandheelkunde?
Werking van proteïnen begrijpen: werkpaarden van de cel in tegenstelling tot DNA
(‘inert’); DNA/erfelijkheidsleer = 2e semester
Invloed van medicijnen op proteïnen (doelwitten van medicijnen- soms zelf
medicijnen)
Aan de basis van allerlei aandoeningen/klinische syndromen
Leren begrijpen hoe proteïnen opgebouwd zijn, en hoe ze functioneren
Werking medicijnen:
Ingebouwd in groeiende polysuikerketen
Transpeptidase: aanhechting pentaglycinebrug op DNA-alanine
Voorkennis organische scheikunde noodzakelijk
Prelude op cel III (enzym, kinetieken, metabolisme)
MCB (schiet wat tekort op vlak van biochemie)
Internet leren gebruiken om problemen op te lossen
Syllabus (leidraad) – noteren?
H1: De zwakke krachten en hun rol in de biochemie
Biochemische processen transiënte / permanente interacties (bindingen) tussen
biomoleculen (…)
Bindingen: zwakke, niet-covalente associaties tussen moleculen (niet permanent):
o H-bruggen
o Ionaire of elektrostatische binding
o Hydrofoob effect
o Van-der-Waals interactie
1.1 Watermoleculen vormen een netwerk van waterstofbruggen
Levende organismen bevatten 70-80% H2O
O trekt gemeenschappelijke elektronenparen van covalente binding naar zich toe (ENW)
Polaire structuur – dipoolmoment
Watermoleculen oriënteren – zwakke interactie = waterstofbrug
Energie H-bruggen tussen watermoleculen 5 kcal/mol (<<< bindingsenergie covalente
binding (O-H = 110 kcal/mol))
Afstand tussen kernen: O-H = 1,2Å – H-bruggen = 2,7Å
Hoog kookpunt van water…
1.2 Waterstofbruggen ontstaan ook tussen biomoleculen met de geschikte functionele
groepen
Geschikte functionele groepen = atomen met elektronegatief karakter (O, N)
OH, NH2, C=O, amidegroepen (oplosbaarheid! hydrofiel)
o Waterstofbrugdonor
o waterstofbrugacceptor
, 1.3 De ionaire binding = elektrostatische binding
Verschil in elektronegatief karakter = groot, elektronenpaar in donor gaat over naar
acceptor (anion)
H+ kan associëren met een ander atoom kation
Wet van Coulomb bepaald aantrekkingskracht
Diëlektriciteitsconstante (D) (water = 80, vacuüm = 1)
Water is goed oplosmiddel voor ionen (dipoolkarakter)
Watermantel ionen (hydratatie-energie komt vrij)
1.4 De van-der-waals-interactie
Niet-polaire moleculen – transciënte dipool – zwakke interactie
Afhankelijk van afstand:
Optimale afstand voor interactie = van-der-Waals-radius: 2x cov binding
Energie 1 kcal/mol (niettemin belangrijk!)
1.5 Het hydrofobe effect
Hydrofoob hydrofiel
Hydrofobe moleculen associëren in waterige oplossing ( waternetwerkstructuur
minder verstoord, want hydrofobe opp kleiner)
Bv. 2 benzeen moleculen
Drijvende kracht bij eiwitopvouwing
1.6 Vele kleine deeltjes maken één groot
Deze krachten: noodzakelijk voor biochemische interacties
Bv. Dubbelstrengig DNA H-brugvorming tussen nucleotiden
Hydrofobe kracht: vorming membraanstructuur
Krachten werken samen:
Secundaire structuureiwitten: H-brugvorming + van-der-Waals + hydrofobe interacties
DNA-binding door transcriptiefactoren elektrostatische interacties en H-brugvorming
Complementariteit !!!
Waarom biochemie geneeskunde/tandheelkunde?
Werking van proteïnen begrijpen: werkpaarden van de cel in tegenstelling tot DNA
(‘inert’); DNA/erfelijkheidsleer = 2e semester
Invloed van medicijnen op proteïnen (doelwitten van medicijnen- soms zelf
medicijnen)
Aan de basis van allerlei aandoeningen/klinische syndromen
Leren begrijpen hoe proteïnen opgebouwd zijn, en hoe ze functioneren
Werking medicijnen:
Ingebouwd in groeiende polysuikerketen
Transpeptidase: aanhechting pentaglycinebrug op DNA-alanine
Voorkennis organische scheikunde noodzakelijk
Prelude op cel III (enzym, kinetieken, metabolisme)
MCB (schiet wat tekort op vlak van biochemie)
Internet leren gebruiken om problemen op te lossen
Syllabus (leidraad) – noteren?
H1: De zwakke krachten en hun rol in de biochemie
Biochemische processen transiënte / permanente interacties (bindingen) tussen
biomoleculen (…)
Bindingen: zwakke, niet-covalente associaties tussen moleculen (niet permanent):
o H-bruggen
o Ionaire of elektrostatische binding
o Hydrofoob effect
o Van-der-Waals interactie
1.1 Watermoleculen vormen een netwerk van waterstofbruggen
Levende organismen bevatten 70-80% H2O
O trekt gemeenschappelijke elektronenparen van covalente binding naar zich toe (ENW)
Polaire structuur – dipoolmoment
Watermoleculen oriënteren – zwakke interactie = waterstofbrug
Energie H-bruggen tussen watermoleculen 5 kcal/mol (<<< bindingsenergie covalente
binding (O-H = 110 kcal/mol))
Afstand tussen kernen: O-H = 1,2Å – H-bruggen = 2,7Å
Hoog kookpunt van water…
1.2 Waterstofbruggen ontstaan ook tussen biomoleculen met de geschikte functionele
groepen
Geschikte functionele groepen = atomen met elektronegatief karakter (O, N)
OH, NH2, C=O, amidegroepen (oplosbaarheid! hydrofiel)
o Waterstofbrugdonor
o waterstofbrugacceptor
, 1.3 De ionaire binding = elektrostatische binding
Verschil in elektronegatief karakter = groot, elektronenpaar in donor gaat over naar
acceptor (anion)
H+ kan associëren met een ander atoom kation
Wet van Coulomb bepaald aantrekkingskracht
Diëlektriciteitsconstante (D) (water = 80, vacuüm = 1)
Water is goed oplosmiddel voor ionen (dipoolkarakter)
Watermantel ionen (hydratatie-energie komt vrij)
1.4 De van-der-waals-interactie
Niet-polaire moleculen – transciënte dipool – zwakke interactie
Afhankelijk van afstand:
Optimale afstand voor interactie = van-der-Waals-radius: 2x cov binding
Energie 1 kcal/mol (niettemin belangrijk!)
1.5 Het hydrofobe effect
Hydrofoob hydrofiel
Hydrofobe moleculen associëren in waterige oplossing ( waternetwerkstructuur
minder verstoord, want hydrofobe opp kleiner)
Bv. 2 benzeen moleculen
Drijvende kracht bij eiwitopvouwing
1.6 Vele kleine deeltjes maken één groot
Deze krachten: noodzakelijk voor biochemische interacties
Bv. Dubbelstrengig DNA H-brugvorming tussen nucleotiden
Hydrofobe kracht: vorming membraanstructuur
Krachten werken samen:
Secundaire structuureiwitten: H-brugvorming + van-der-Waals + hydrofobe interacties
DNA-binding door transcriptiefactoren elektrostatische interacties en H-brugvorming
Complementariteit !!!