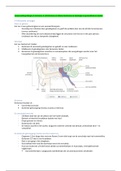
1. Reactiesnelheid
4 factoren beïnvloeden deze v
1) Concentratie vd reagentia en reactieproducten (kans op onderlinge botsingen ↑)
2) Fysische toestand (gas processen gaan sneller dan vaste stoffen)
3) Temperatuur (Arrheniusgedrag)
4) Katalysator
● Reactie: A2 (g) + B2 (g) → 2AB (g)
[𝐴𝐵]𝑡2−[𝐴𝐵]𝑡1 ∆[𝐴𝐵]
● gemiddelde reactiesnelheid: va = 𝑡2−𝑡1
= ∆𝑡
[𝐴]𝑡2−[𝐴]𝑡1 ∆[𝐴]
● Snelheid vd concentratieafname van A2 (g): vb = 𝑡2−𝑡1
=– ∆𝑡
● AB worden dubbel zo snel gevormd als A2 en B2 wegreageren + snelheden zijn NIET
cte in functie vd tijd
−𝑑[𝐴] −𝑑[𝐵] 𝑑[𝐴𝐵]
● v = 𝑑𝑡
= 𝑑𝑡 = 2𝑑𝑡
2. Reactiesnelheidsvergelijking
1) Differentiële vgl
→ relatie tss reactiesnelheid en concentraties
[
→ vb k 𝑁𝑂2 n ]
2) Geïntegreerde vgl
→ relatie tss concentratie en tijd
● Algemeen
○ reactie: A + B + C + … → …
○ reactiesnelheid = k [𝐴]n [𝐵]p [𝐶]q …
○ opm:
■ concentraties vd reactieproducten w niet weergegeven in de vgl
■ n, p, q moeten experimenteel bep w + NIET noodzakelijk gehele
getallen
■ Orde vd tot reactie = som vd orden v elk vd elementen
■ eenheid k is afhankelijk vd vorm vd vgl
● Belang
○ fundamenteel: voorspellingen omtrent reactiemechanisme
○ technologisch: duur en opbrengst per tijdseenheid ve nuttige che reactie
3. Orde ve reactie
● v = k [𝐴] eerste orde in A
● v = k [𝐴]2 tweede orde in A
● v = k [𝐴][𝐵] tweede orde (eerste orde in A, eerste orde in B)
● v = k nulde orde (vb gekatalyseerde reactie)
, 4. Reactie van de eerste orde
● Geïntegreerde vgl
● Halfwaardetijd
● Linearisering
● Radioactief verval
○ α = 23892U → 42He + 23490Th
○ β = 8737Rb → 0-1e- + 8738Sr
○ γ = uitstoot van foton met zeer korte golflengte
○ radioactief verval → halfwaardetijd !