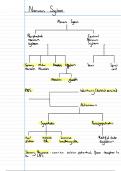
Introductie
Lavoisier = wet van behoud van massa EN energie
Analytische scheidkunde = scheiden van bestanddelen in sample en bestanddelen identificeren
voorkomen als vloeistof (= siroop), gas (= medicinale zuurstof), vast (= tablet)
GM vormen bevat altijd actief bestanddeel (= API active pharmaceutical ingrediënt)
bevat zoetstoffen, smaak, hulpstoffen,…
Counterfeits gm valse gm, lijkt qua uiterlijk, verpakking,… heel erg op echte gm
kan niets bevatten, heeft geen werking
verkeerde API bevatten
kan een foute dosering van API bevatten
Kwalitatieve analyse aanwezigheid aantonen = pure substanties identificeren, comp van mix
aantonen
afwezigheid aantonen = zuiverheidstest
Sensitieve techniek = hoe laag je iets kan bepalen, de gevoeligheidsmeetmethode
Specifieke techniek = kans dat bestanddeel er in zit bepalen
Kwantitatieve analyse relatief in een percentage weergeven
in een absolute hoeveelheid weergeven
Precisie = toont verspreiding van de data aan
Accuraatheid = het gemiddelde van al de pogingen rapporteren
Semi-kwantitatieve analyse aantonen dat de stof aanwezig is en er een grootheid aan binden
de hoeveelheid niet exact bepalen
enkele-, gedeeltelijke- of totale analyse
Hoeveelheid van onderzoek sample Macroanalyse: >100mg / >1000µl
Semi-microanalyse: 100mg - 10mg / 1000µl – 100µl
Microanalyse: 10mg – 1mg / 100µl – 10µl
Ultramicroanalyse: <1mg / <10µl
Standaard deviatie (= RSD) = zegt iets meer over spreiding van meetresultaat (= HEEL NAUWKEURIG)
Stoichiometrisch punt = als 1 van beide componenten is op gereageerd, dit is zichtbaar
Instrumentale methode = met machinerie, heeeel hoge nauwkeurigheid, maar een grotere afwijking
van de accurity
Biological assay heeft een heel grote spreiding
gemiddelde van de data is wel juist, als je de proef voldoende uitvoert
Standaard units
,*volume = afgeleide
van m^3
Prefixen
Concentratie m = hoeveelheid opgeloste stof
a = hoeveelheid solvent
f = arbitraire eenheid (= om tussen prefixen om te rekenen)
massa: (= m en a allebei massa, dus m/m)
% percent 1O2 g/100g
ppu Parts per unit 1O0 g/g
ppm Parts per million 1O6 µg/g
ppb Parts per billion 1O9 ng/g
vloeistof: (= m = massa, a= volume, dus (m/v)
, % m/V percent 1O2 g/100mL
ppu Parts per unit 1O0 g/mL of mg/µL
ppm Parts per million 1O6 µg/mL of ng/µL
ppb Parts per billion 1O9 ng/mL of pg/µL
vloeistof: (= m en a allebei volume, dus v/v)
% percent 1O2 mL/100mL
ppu Parts per unit 1O0 mL/mL
ppm Parts per million 1O6 nL/mL
ppb Parts per billion 1O9 pL/mL
gassen: (= m en a allebei volume, dus v/v)
% percent 1O2 mL/100mL
ppu Parts per unit 1O0 mL/mL
ppm Parts per million 1O6 nL/mL
ppb Parts per billion 1O9 pL/mL
Gramatoom = hoeveelheid materiaal dat in hoeveelheid overeenkomt met aantal deeltjes dat in 12g
van koolstof 12 atoom. Dit komt overeen met getal van Avogadro = 6,022 . 10^23 deeltjes.
= gram molecule of mole
Molariteit = aantal moles per liter oplossing gram / ( moleculair gewicht . volume(=liter))
𝒈×𝒛
uitgebreide formule: 𝑴 = z = ionenaantal
𝑴𝑮×𝑽
vb. Na2CO3 M(Na+) = 2M
1mol => 1l M(CO3^2-) = 1M
Molaliteit = aantal molecules per kilogram solvent
Molaliteit vs # mol per kg product aantal mol per kilogram product, dan is productmassa bestaand
uit solvent EN opgeloste stof
, 𝒎
Dichtheid : 𝝆 = ! uitgedrukt in g/ml OF kg/l
𝑽
Chemisch evenwicht
Redoxreactie = er is een oxiderend en een reducerende component
de stoichiometrie is de verhouding die bepaalt hoe componenten tov elkaar gaan reageren
Goede titratie wordt bepaald door ligging van evenwicht
reactiesnelheid
Wet van Gulberd en Waage = bepalen evenwichtsconstante K 𝒂𝑨 + 𝒃𝑩 ⇄ 𝒄𝑪 + 𝒅𝑫
K>1 een betere voorwaardse reactie
[𝑪]𝒄 [𝑫]𝒅
K<1 een betere terugwaardse reactie 𝑲 = [𝑨]𝒂[𝑩]𝒃
Goede nauwkeurigheid voor titratie bereiken? K waarde van minstens 10^6 – 10^8
K is een dimentieloze waarde ! (= werkt in verhouding van concentraties)
Verschillende standaard staten oplossing = 1M
gas = 1 bar
pure vaste stoffen / pure oplossing = 1
solvent = 1 (= benaderend, berekenen)
! som van 2 reacties, dan moet je product van evenwichtsconstanten nemen! 𝑲 = 𝑲𝟏 × 𝑲𝟐
( resultaat van product van 2 K-waarden)
Enthalpie = maat voor warmte die wordt opgenomen / afgegeven tijdens een reactie
Exotherm = er wordt warmte afgegeven, H<0
Endotherm = er wordt warmte opgenomen, H>0
Entropie = maat voor wanorde
S<0, wanorde verdwijnt
S>0, wanorde neemt toe
bevoordeelde entropie = alles dat van structuur naar wanorde gaat
vast (= minst wanorde) -> vloeistof -> gas (= meest wanorde); entropie toename
Gibbs vrije energie verandering = reactie die beschrijft wanneer reactie best doorgaat
∆𝑮 = ∆𝑯 − 𝑻∆𝑺 𝑇 = in Kelvin
Lavoisier = wet van behoud van massa EN energie
Analytische scheidkunde = scheiden van bestanddelen in sample en bestanddelen identificeren
voorkomen als vloeistof (= siroop), gas (= medicinale zuurstof), vast (= tablet)
GM vormen bevat altijd actief bestanddeel (= API active pharmaceutical ingrediënt)
bevat zoetstoffen, smaak, hulpstoffen,…
Counterfeits gm valse gm, lijkt qua uiterlijk, verpakking,… heel erg op echte gm
kan niets bevatten, heeft geen werking
verkeerde API bevatten
kan een foute dosering van API bevatten
Kwalitatieve analyse aanwezigheid aantonen = pure substanties identificeren, comp van mix
aantonen
afwezigheid aantonen = zuiverheidstest
Sensitieve techniek = hoe laag je iets kan bepalen, de gevoeligheidsmeetmethode
Specifieke techniek = kans dat bestanddeel er in zit bepalen
Kwantitatieve analyse relatief in een percentage weergeven
in een absolute hoeveelheid weergeven
Precisie = toont verspreiding van de data aan
Accuraatheid = het gemiddelde van al de pogingen rapporteren
Semi-kwantitatieve analyse aantonen dat de stof aanwezig is en er een grootheid aan binden
de hoeveelheid niet exact bepalen
enkele-, gedeeltelijke- of totale analyse
Hoeveelheid van onderzoek sample Macroanalyse: >100mg / >1000µl
Semi-microanalyse: 100mg - 10mg / 1000µl – 100µl
Microanalyse: 10mg – 1mg / 100µl – 10µl
Ultramicroanalyse: <1mg / <10µl
Standaard deviatie (= RSD) = zegt iets meer over spreiding van meetresultaat (= HEEL NAUWKEURIG)
Stoichiometrisch punt = als 1 van beide componenten is op gereageerd, dit is zichtbaar
Instrumentale methode = met machinerie, heeeel hoge nauwkeurigheid, maar een grotere afwijking
van de accurity
Biological assay heeft een heel grote spreiding
gemiddelde van de data is wel juist, als je de proef voldoende uitvoert
Standaard units
,*volume = afgeleide
van m^3
Prefixen
Concentratie m = hoeveelheid opgeloste stof
a = hoeveelheid solvent
f = arbitraire eenheid (= om tussen prefixen om te rekenen)
massa: (= m en a allebei massa, dus m/m)
% percent 1O2 g/100g
ppu Parts per unit 1O0 g/g
ppm Parts per million 1O6 µg/g
ppb Parts per billion 1O9 ng/g
vloeistof: (= m = massa, a= volume, dus (m/v)
, % m/V percent 1O2 g/100mL
ppu Parts per unit 1O0 g/mL of mg/µL
ppm Parts per million 1O6 µg/mL of ng/µL
ppb Parts per billion 1O9 ng/mL of pg/µL
vloeistof: (= m en a allebei volume, dus v/v)
% percent 1O2 mL/100mL
ppu Parts per unit 1O0 mL/mL
ppm Parts per million 1O6 nL/mL
ppb Parts per billion 1O9 pL/mL
gassen: (= m en a allebei volume, dus v/v)
% percent 1O2 mL/100mL
ppu Parts per unit 1O0 mL/mL
ppm Parts per million 1O6 nL/mL
ppb Parts per billion 1O9 pL/mL
Gramatoom = hoeveelheid materiaal dat in hoeveelheid overeenkomt met aantal deeltjes dat in 12g
van koolstof 12 atoom. Dit komt overeen met getal van Avogadro = 6,022 . 10^23 deeltjes.
= gram molecule of mole
Molariteit = aantal moles per liter oplossing gram / ( moleculair gewicht . volume(=liter))
𝒈×𝒛
uitgebreide formule: 𝑴 = z = ionenaantal
𝑴𝑮×𝑽
vb. Na2CO3 M(Na+) = 2M
1mol => 1l M(CO3^2-) = 1M
Molaliteit = aantal molecules per kilogram solvent
Molaliteit vs # mol per kg product aantal mol per kilogram product, dan is productmassa bestaand
uit solvent EN opgeloste stof
, 𝒎
Dichtheid : 𝝆 = ! uitgedrukt in g/ml OF kg/l
𝑽
Chemisch evenwicht
Redoxreactie = er is een oxiderend en een reducerende component
de stoichiometrie is de verhouding die bepaalt hoe componenten tov elkaar gaan reageren
Goede titratie wordt bepaald door ligging van evenwicht
reactiesnelheid
Wet van Gulberd en Waage = bepalen evenwichtsconstante K 𝒂𝑨 + 𝒃𝑩 ⇄ 𝒄𝑪 + 𝒅𝑫
K>1 een betere voorwaardse reactie
[𝑪]𝒄 [𝑫]𝒅
K<1 een betere terugwaardse reactie 𝑲 = [𝑨]𝒂[𝑩]𝒃
Goede nauwkeurigheid voor titratie bereiken? K waarde van minstens 10^6 – 10^8
K is een dimentieloze waarde ! (= werkt in verhouding van concentraties)
Verschillende standaard staten oplossing = 1M
gas = 1 bar
pure vaste stoffen / pure oplossing = 1
solvent = 1 (= benaderend, berekenen)
! som van 2 reacties, dan moet je product van evenwichtsconstanten nemen! 𝑲 = 𝑲𝟏 × 𝑲𝟐
( resultaat van product van 2 K-waarden)
Enthalpie = maat voor warmte die wordt opgenomen / afgegeven tijdens een reactie
Exotherm = er wordt warmte afgegeven, H<0
Endotherm = er wordt warmte opgenomen, H>0
Entropie = maat voor wanorde
S<0, wanorde verdwijnt
S>0, wanorde neemt toe
bevoordeelde entropie = alles dat van structuur naar wanorde gaat
vast (= minst wanorde) -> vloeistof -> gas (= meest wanorde); entropie toename
Gibbs vrije energie verandering = reactie die beschrijft wanneer reactie best doorgaat
∆𝑮 = ∆𝑯 − 𝑻∆𝑺 𝑇 = in Kelvin