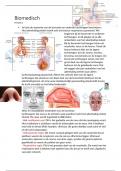
Variable Oxidation States
One of the properties of transition metals is that they can exist in variable oxidation states.
When you switch between oxidation states a redox reaction occurs as the metals are either
oxidised or reduced. Those in higher oxidation states are more likely to be reduced.
Oxidation Formula Other Colour of Ion
State of e of Ion Formulae of
Vanadium Ion
+5 VO2+ [VO2(H2O)4] yellow
+
+4 VO2+ [VO(H2O)5]2+ blue
+3 V3+ [V(H2O)5]3+ green
+2 V2+ [V(H2O)5]3+ purple (violet)
Vanadium can be reduced by being added to zinc metals in an acidic solution.
Ligands
Standard electrode potential is measured in an aqueous solution. So any ions are
surrounded by water ligands. They can make the redox potential smaller/larger depending
on how they bind to the metal ion in a particular oxidative state.
pH
Some ions need H+ ions in order to be reduced. Others release OH- ions into the solution
when reduced. This causes pH to affect the size of the redox potential. Redox potentials
are more positive in acidic solutions as ions are more easily reduced.
It is easier to oxidise a transition metal in alkaline conditions.
It is easier to reduce a transition metal in acidic conditions.
Redox potentials are recorded under standard conditions. Different ligands surround the metal
ion and affect the redox potential as the strength of the coordinate bond changes. Redox
reactions are reversible therefore Le Chatelier's principle can be applied and they are affected
by pH. Some reduction processes need a source of H+ ions and some produce OH- ions.
More acidic solutions have a more positive redox potential and they are reduced more easily.
One of the properties of transition metals is that they can exist in variable oxidation states.
When you switch between oxidation states a redox reaction occurs as the metals are either
oxidised or reduced. Those in higher oxidation states are more likely to be reduced.
Oxidation Formula Other Colour of Ion
State of e of Ion Formulae of
Vanadium Ion
+5 VO2+ [VO2(H2O)4] yellow
+
+4 VO2+ [VO(H2O)5]2+ blue
+3 V3+ [V(H2O)5]3+ green
+2 V2+ [V(H2O)5]3+ purple (violet)
Vanadium can be reduced by being added to zinc metals in an acidic solution.
Ligands
Standard electrode potential is measured in an aqueous solution. So any ions are
surrounded by water ligands. They can make the redox potential smaller/larger depending
on how they bind to the metal ion in a particular oxidative state.
pH
Some ions need H+ ions in order to be reduced. Others release OH- ions into the solution
when reduced. This causes pH to affect the size of the redox potential. Redox potentials
are more positive in acidic solutions as ions are more easily reduced.
It is easier to oxidise a transition metal in alkaline conditions.
It is easier to reduce a transition metal in acidic conditions.
Redox potentials are recorded under standard conditions. Different ligands surround the metal
ion and affect the redox potential as the strength of the coordinate bond changes. Redox
reactions are reversible therefore Le Chatelier's principle can be applied and they are affected
by pH. Some reduction processes need a source of H+ ions and some produce OH- ions.
More acidic solutions have a more positive redox potential and they are reduced more easily.