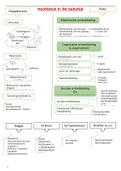
12.1 Lewisstructuren
Volgens de octetregel binden atomen met elkaar om edelgasconfiguratie te krijgen, dit
houdt in dat elk atoom 8 valentie-elektronen heeft (met uitzondering op H-atomen).
Zuurstof heeft bijvoorbeeld 6 valentie-elektronen en het heeft 2 elektronen nodig om te
voldoen aan de octetregel, je zegt dan dat de covalentie twee is.
Lewisstructuren zijn de structuurformules van moleculen, maar met de valentie-elektronen
erbij getekend. Deze structuren worden alleen toegepast bij moleculaire stoffen. Voor het
opstellen van een Lewisstructuur gebruik je het volgende schema:
1. Valentie Tel alle valentie-elektronen van je molecuul bij elkaar op en deel dit getal
door twee om te weten hoeveel elektronen paren dat zijn.
2. Octet Tel hoeveel elektronen elk atoom in je molecuul nodig heeft om te voldoen
aan de octetregel vervolgens deel je dit getal door twee. Bij elk atoom is dit 8
behalve bij H-atomen, hier is dit getal 2.
3. Bindend Om te weten hoeveel elektronenparen in de molecuul een binding vormen
doe je het getal dat je bij de octet stap hebt gekregen min het getal bij de
valentie stap. Dus: Octet – Valentie = Bindende elektronenparen.
4. Niet Om te weten hoeveel elektronenparen niet binden doe je het getal van de
bindend valentie min het getal bij bindend. Dus: Valentie – bindend = niet bindende
elektronenparen.
Met de informatie die je nu hebt verkregen over het aantal bindende en niet bindende
elektronenparen kan je de Lewisstructuur opstellen. De bindende elektronenparen geef je
aan met een streep en de niet bindende elektronenparen kan je aangeven met een stippen
(1 per elektron) of met een streep (1 per elektronenpaar).
Uitzonderingen
Soms kan bij een centraal P-, N- of S-atoom het aantal omringende elektronen
groter zijn dan 8, je spreekt dan van een uitgebreid octet. Dit is te bij het centrale
S-atoom van het molecuul hiernaast met een covalentie van 6 (dus 12 omringende
elektronen). Als er een uitgebreid octet aanwezig is dan wordt dit vermeld door
de covalentie van het centrale atoom te geven.
Radicalen
Een radicaal is een deeltje waarbij niet alle elektronen in paren voorkomen, door het
ongepaarde elektron voldoet een radicaal niet aan de octetregel en reageert het snel met
andere atomen. Een radicaal wordt bij een molecuulformule aangegeven met een stip, dus
CH3O• teken je als:
Ionen
Bij ionen hou je rekening met de lading. Is het positief geladen dan trek je elektronen af van
het getal bij de eerste stap, is het negatief geladen dan tel je elektronen bij het getal van de
eerste stap erbij.
, Formele lading
Soms heeft een atoom meer elektronen dan dat er voorkomt bij het
oorspronkelijke aantal valantie-elektronen, het atoom krijgt dan een formele
lading. Heeft het atoom meer elektronen dan het oorspronkelijke aantal valentie-
elektronen, dan is de formele lading negatief. Heeft een atoom minder elektronen
dan het oorspronkelijke aantal valentie-elektronen, dan is de formele lading positief.
De som van alle formele ladingen is bij neutrale moleculen 0, maar je moet bij de
Lewisstructuren nog steeds de formele ladingen aanduiden.
Vaak kan je meerdere Lewisstructuren opstellen voor een combinatie van atomen,
maar over het algemeen geldt dat de structuur met de minste formele ladingen de correcte
is.
12.2 VSEPR-theorie
Soorten bindingen
Polaire en apolaire atoombindingen
het bindende elektronen paar bevindt zich soms dichterbij de een dan bij de andere atoom,
dit komt door de aantrekkingskracht die deze atomen hebben. Deze aantrekkingskracht
wordt uitgedrukt in elektronegativiteit (Binas tabel 40A). Het atoom in een binding met de
hoogste elektronegativiteit (ΔEN) wordt negatief geladen (δ−) en de andere positief (δ+). Je
spreekt dan van een polaire atoombinding met partiële ladingen. Afhankelijk van het
verschil in elektronegativiteit heb je verschillende bindingen:
Vanderwaalsbinding
Moleculen ondervinden tussen elkaar een aantrekkende kracht waardoor een
vanderwaalsbinding wordt gevormd. Hoe hoger de molecuulmassa hoe groter de
vanderwaalsbinding.
Waterstofbruggen
Tussen moleculen met NH- en OH-groepen, de N- of O-atoom trekt de H-atoom van een
ander molecuul aan waarbij een binding genaamd waterstofbrug ontstaat. Stoffen die
waterstofbruggen kunnen vormen zijn goed oplosbaar.
Ruimtelijke bouw
Bij de VSEPR-methode voorspel je de bouw van een molecuul door gebruik te maken van het
feit dat vrije en bindende elektronenparen zo ver mogelijk van elkaar af zitten, omdat ze
elkaar afstoten. Door de omringingsgetal (aantal atomen direct gebonden aan centrale
atoom + vrije elektronenparen) van het centrale atoom in een molecuul voorspel je de
bouw:
In Binas tabel 53B vind je
bindingshoeken van moleculen die
afwijken