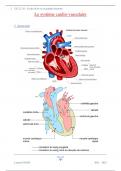
VI. Cellular Metabolisme
1. Fundamentals
1. Oxidatie en reductie
Bij een redoxreactie is er spraken van een elektronenoverdracht. Ze gaan vaak gepaard met
een grote energie verandering
Bij het op nemen van elektronen wordt het gereduceerd: 𝑋 + 𝑒− → 𝑋−
Bij het verliezen van elektronen wordt het geoxideerd: 𝑋 → 𝑋+ + 𝑒−
Bij 2 𝐻2 + 𝑂2 → 2 𝐻2 𝑂2, is H geoxideerd, O gereduceerd. O is dus de oxidator en H de
reductor. De oxidator neemt elektronen op en wordt gereduceerd. De reductor staat
elektronen af en wordt dus geoxideerd.
Bij (wild)vuur wordt Carbon geoxideerd en zuurstof gereduceerd.
2. Redox
Een volledige redox reacties bestaat uit 2
half reacties. Je hebt redoxkoppels. Het
redox potentiaal (E) geeft de neiging aan
van een bepaald atoom/molecuul om
elektronen op/af te geven. Hoe
negatiever, hoe meer elektronen hij
afgeeft. Hoe positiever E is, hoe sneller hij
elektronen opneemt. Het standaard
redoxpotentiaal is 𝐸 0 , de neiging tot elektronenacceptatie bij
1 M concentraties van de gereduceerde en geoxideerde vorm
van een bepaalde verbinding bij pH = 0 (1 M protonen) en 1
bar druk en 25 °C. De 𝐸 𝑜 ′ is bij pH = 7.
Sommige waardes zijn bij 𝐸 0 en 𝐸 𝑜 ′ gelijk, dit komt door protonering/deprotonering.
𝑅𝑇 [𝑂𝑥]
𝐸 = 𝐸 0 + 𝑧𝐹 𝑙𝑛 [𝑅𝑒𝑑]
𝑅 = 𝑔𝑎𝑠𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒, 8.3145 𝐽𝑚𝑜𝑙 −1 𝐾 −1 , 𝑇 = 𝑡𝑒𝑚𝑝. 𝑖𝑛 𝐾,
𝑧 = 𝑎𝑎𝑛𝑡𝑎𝑙 𝑜𝑣𝑒𝑟𝑔𝑒𝑑𝑟𝑎𝑔𝑒𝑛 𝑒𝑙𝑒𝑘𝑡𝑟𝑜𝑛𝑒𝑛 (𝑡𝑎𝑏𝑒𝑙) 𝑒𝑛
𝐹 = 𝐹𝑎𝑟𝑎𝑑𝑎𝑦 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒, 96485 𝐽 𝑉 −1 𝑚𝑜𝑙 −1
25:1 - > (ox/red)=3.22 mV, z=n=2, T=298 K.
RT/zF = 12.6 mV -> RT/zF ln (ox/red) = 12.6 mV x 3.22 mV = 40.6 mV.
E = 30 + 40.6 = 71 mV
3. Energieverandering
De Vrije energieverandering (∆𝑮) van een bepaalde redoxreactie kan worden berekend uit
het verschil van redoxpotentialen (∆𝑬). ∆𝐺 = −𝑧𝐹 ∙ ∆𝐸
De sterkte van de interactie van elektronen met hun kernen wordt bepaald door de
elektronegativiteit van het betreffende atoom. Dit hangt af van:
- Grootte van de elektronenwolk,
- Afstand van buitenste schil tot kern,
- Ladingsdichtheid binnen de kern
Meer elektronegatieve atomen (zuurstof) houden elektronen beter vast, wat een lagere
bijbehorende energie impliceert in vergelijking met losser gebonden elektronen (koolstof).
, De verschuiving van elektronen van C-C of C-H bindingen naar C-O bindingen maakt dit
verschil in de energie vrij.
4. Kenmerken van redoxreacties
Je kan een moeilijk herkenbare redoxreactie herkennen door
elektronen te tellen. Links: 20 elektronen, rechts: 18 elektronen.
Tijdens de reactie is de ring dus geoxideerd.
Oxidatietoestand (redox-toestand): maat voor de mate van oxidatie van een atoom in een
chemische verbinding, de hypothetische lading de een atoom zou hebben als al zijn
bindingen met verschillende soorten atomen zou ioniseren. Deze toestanden worden
aangeduid door romeinse cijfers.
CO2 is het meest geoxideerd en heeft een oxidatie toestand van +IV.
Al hij helemaal gereduceerd wordt, CH4, is er een toestand van -IV (methaan).
2. Metabole Routes
1. Glycolyse
a. De investeringsfase
Bij 1 wordt glucose gefosforyleerd tot hexokinase door 1
ATP. Bij 2 wordt Glucose-6-fosfaat omgezet naar fructose-6-
fosfaat (de aldose verandert in ketose). En bij 3 wordt
fructose-6-fosfaat gefosforyleerd tot fructose-1,6-bisfosfaat
(ATP 2 verbruikt).
Door fosfaat aan glucose te plakken, kan glucose zelf naar binnen
getransporteerd worden (substraat) maar dan kan het niet meer naar buiten
getransporteerd worden (+p is geen substraat).
Doordat de lineaire vorm van glucose-6-fosfaat (aldose groep) verandert in de lineaire groep
van fructose-6-fosfaat (ketose groep), kan bij stap 2 de verandering plaatsvinden.
Fructose-1,6-bisfosfaat kan vervolgens bij stap 4 lineair gemaakt worden, en dan bij 5
opgesplitst worden in 2 triose moleculen.
b. De amortische fase
Een oxidatie van een redoxreactie. Het koolstof atoom wordt
geoxideerd. Bij de 2de reactie wordt de fosfaat groep
overgedragen naar ADP waardoor het ATP wordt.
1. Fundamentals
1. Oxidatie en reductie
Bij een redoxreactie is er spraken van een elektronenoverdracht. Ze gaan vaak gepaard met
een grote energie verandering
Bij het op nemen van elektronen wordt het gereduceerd: 𝑋 + 𝑒− → 𝑋−
Bij het verliezen van elektronen wordt het geoxideerd: 𝑋 → 𝑋+ + 𝑒−
Bij 2 𝐻2 + 𝑂2 → 2 𝐻2 𝑂2, is H geoxideerd, O gereduceerd. O is dus de oxidator en H de
reductor. De oxidator neemt elektronen op en wordt gereduceerd. De reductor staat
elektronen af en wordt dus geoxideerd.
Bij (wild)vuur wordt Carbon geoxideerd en zuurstof gereduceerd.
2. Redox
Een volledige redox reacties bestaat uit 2
half reacties. Je hebt redoxkoppels. Het
redox potentiaal (E) geeft de neiging aan
van een bepaald atoom/molecuul om
elektronen op/af te geven. Hoe
negatiever, hoe meer elektronen hij
afgeeft. Hoe positiever E is, hoe sneller hij
elektronen opneemt. Het standaard
redoxpotentiaal is 𝐸 0 , de neiging tot elektronenacceptatie bij
1 M concentraties van de gereduceerde en geoxideerde vorm
van een bepaalde verbinding bij pH = 0 (1 M protonen) en 1
bar druk en 25 °C. De 𝐸 𝑜 ′ is bij pH = 7.
Sommige waardes zijn bij 𝐸 0 en 𝐸 𝑜 ′ gelijk, dit komt door protonering/deprotonering.
𝑅𝑇 [𝑂𝑥]
𝐸 = 𝐸 0 + 𝑧𝐹 𝑙𝑛 [𝑅𝑒𝑑]
𝑅 = 𝑔𝑎𝑠𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒, 8.3145 𝐽𝑚𝑜𝑙 −1 𝐾 −1 , 𝑇 = 𝑡𝑒𝑚𝑝. 𝑖𝑛 𝐾,
𝑧 = 𝑎𝑎𝑛𝑡𝑎𝑙 𝑜𝑣𝑒𝑟𝑔𝑒𝑑𝑟𝑎𝑔𝑒𝑛 𝑒𝑙𝑒𝑘𝑡𝑟𝑜𝑛𝑒𝑛 (𝑡𝑎𝑏𝑒𝑙) 𝑒𝑛
𝐹 = 𝐹𝑎𝑟𝑎𝑑𝑎𝑦 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒, 96485 𝐽 𝑉 −1 𝑚𝑜𝑙 −1
25:1 - > (ox/red)=3.22 mV, z=n=2, T=298 K.
RT/zF = 12.6 mV -> RT/zF ln (ox/red) = 12.6 mV x 3.22 mV = 40.6 mV.
E = 30 + 40.6 = 71 mV
3. Energieverandering
De Vrije energieverandering (∆𝑮) van een bepaalde redoxreactie kan worden berekend uit
het verschil van redoxpotentialen (∆𝑬). ∆𝐺 = −𝑧𝐹 ∙ ∆𝐸
De sterkte van de interactie van elektronen met hun kernen wordt bepaald door de
elektronegativiteit van het betreffende atoom. Dit hangt af van:
- Grootte van de elektronenwolk,
- Afstand van buitenste schil tot kern,
- Ladingsdichtheid binnen de kern
Meer elektronegatieve atomen (zuurstof) houden elektronen beter vast, wat een lagere
bijbehorende energie impliceert in vergelijking met losser gebonden elektronen (koolstof).
, De verschuiving van elektronen van C-C of C-H bindingen naar C-O bindingen maakt dit
verschil in de energie vrij.
4. Kenmerken van redoxreacties
Je kan een moeilijk herkenbare redoxreactie herkennen door
elektronen te tellen. Links: 20 elektronen, rechts: 18 elektronen.
Tijdens de reactie is de ring dus geoxideerd.
Oxidatietoestand (redox-toestand): maat voor de mate van oxidatie van een atoom in een
chemische verbinding, de hypothetische lading de een atoom zou hebben als al zijn
bindingen met verschillende soorten atomen zou ioniseren. Deze toestanden worden
aangeduid door romeinse cijfers.
CO2 is het meest geoxideerd en heeft een oxidatie toestand van +IV.
Al hij helemaal gereduceerd wordt, CH4, is er een toestand van -IV (methaan).
2. Metabole Routes
1. Glycolyse
a. De investeringsfase
Bij 1 wordt glucose gefosforyleerd tot hexokinase door 1
ATP. Bij 2 wordt Glucose-6-fosfaat omgezet naar fructose-6-
fosfaat (de aldose verandert in ketose). En bij 3 wordt
fructose-6-fosfaat gefosforyleerd tot fructose-1,6-bisfosfaat
(ATP 2 verbruikt).
Door fosfaat aan glucose te plakken, kan glucose zelf naar binnen
getransporteerd worden (substraat) maar dan kan het niet meer naar buiten
getransporteerd worden (+p is geen substraat).
Doordat de lineaire vorm van glucose-6-fosfaat (aldose groep) verandert in de lineaire groep
van fructose-6-fosfaat (ketose groep), kan bij stap 2 de verandering plaatsvinden.
Fructose-1,6-bisfosfaat kan vervolgens bij stap 4 lineair gemaakt worden, en dan bij 5
opgesplitst worden in 2 triose moleculen.
b. De amortische fase
Een oxidatie van een redoxreactie. Het koolstof atoom wordt
geoxideerd. Bij de 2de reactie wordt de fosfaat groep
overgedragen naar ADP waardoor het ATP wordt.