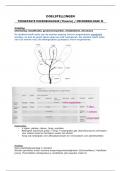
7. Organische reactiviteit – additie aan de π-binding
Additiereactie = reactie waarbij π-binding in alkeen verbroken wordt met vorming van 2
nieuwe σ-bindingen:
Over het algemeen: niet stereoselectief ⇒ racemisch mengsel (ongunstig)
1. Additie van zuren HX
In 2 stappen, toegepast op HCl + H2C=CH2:
Stap1: elektrofiele additie
o Elektronenpaar π-binding wordt gebruikt om σ-binding te maken met het
elektrofiel
o Er ontstaat C-H-binding.
o Hierdoor ontstaat een carbokation (= energetisch reactieintermediair) op ander
het koolstofatoom: H+ + CH2=CH2 + |Cl- → H-CH2-CH2+ + |Cl-
Stap2:
o Nucleofiele aanval van het elektronrijke chlooranion op het carbokation
o carbokation reageert met nucleofiel met vorming van C-Cl σ-binding:
H-CH2-CH2+ + |Cl- → H-CH2-CH2-Cl
Regel van Markovnikov:
additie van niet-symmetrisch reagens (waterstofhalogenide) aan een niet symmetrisch
alkeen, verkrijgt het sp2 C-atoom met grootste aantal waterstoffen het extra waterstof.
(Door vorming meest stabiele intermediair carbokation)
Hoe meer koolstofsubstituenten gebonden aan centraal carbokation-C-atoom, hoe stabieler
het carbokation.
1
Additiereactie = reactie waarbij π-binding in alkeen verbroken wordt met vorming van 2
nieuwe σ-bindingen:
Over het algemeen: niet stereoselectief ⇒ racemisch mengsel (ongunstig)
1. Additie van zuren HX
In 2 stappen, toegepast op HCl + H2C=CH2:
Stap1: elektrofiele additie
o Elektronenpaar π-binding wordt gebruikt om σ-binding te maken met het
elektrofiel
o Er ontstaat C-H-binding.
o Hierdoor ontstaat een carbokation (= energetisch reactieintermediair) op ander
het koolstofatoom: H+ + CH2=CH2 + |Cl- → H-CH2-CH2+ + |Cl-
Stap2:
o Nucleofiele aanval van het elektronrijke chlooranion op het carbokation
o carbokation reageert met nucleofiel met vorming van C-Cl σ-binding:
H-CH2-CH2+ + |Cl- → H-CH2-CH2-Cl
Regel van Markovnikov:
additie van niet-symmetrisch reagens (waterstofhalogenide) aan een niet symmetrisch
alkeen, verkrijgt het sp2 C-atoom met grootste aantal waterstoffen het extra waterstof.
(Door vorming meest stabiele intermediair carbokation)
Hoe meer koolstofsubstituenten gebonden aan centraal carbokation-C-atoom, hoe stabieler
het carbokation.
1