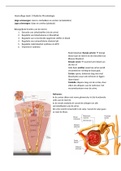
La anemia se define como una reducción de la masa total de eritrocitos circulantes por debajo de los límites normales. Esto último se define en base al hematocrito y la
concentración de hemoglobina. Las características morfológicas que aportan las claves etiológicas son el tamaño de los eritrocitos, su grado de hemoglobinización y su
forma. Pero sea cual sea su causa, una anemia lo suficientemente intensa provoca: palidez, debilidad, malestar y fatiga fácil, y la afectación de aquellos órganos más
susceptibles a la caída de O2, como el corazón y SNC.
I- POR PÉRDIDA DE SANGRE
En los casos agudos y masivos, podría llegar a provocar el colapso cardiovascular, shock y muerte. Si el paciente sobrevive a la hemorragia, el volumen circulante se
recompone rápidamente por el desplazamiento de agua desde el IC, que da lugar a una hemodilución y descenso del Hto. La respuesta esperable ante una hemorragia
significativa da lugar a cambios en eritrocitos, leucocitos y plaquetas:
➔ La hipoxia renal desencadena la liberación de Epo, que estimula la proliferación de los progenitores eritroides comprometidos en MO. Dentro de 5 días aprox, su
progenie aparecerá en sangre como reticulocitos (reticulocitosis)
➔ La intensa respuesta adrenérgica encargada de mantener la TA también moviliza los granulocitos desde la reserva marginal y da lugar a una leucocitosis.
➔ Hay trombocitosis por aumento en la producción de plaquetas
II- ANEMIAS HEMOLÍTICAS
Todas comparten los siguientes elementos: reducción de la vida media de los GR, elevación de la Epo como rta compensatoria, acumulación de los productos de
degradación de la Hb (por la hemólisis). Fisiológicamente, la destrucción de los eritrocitos senescentes tiene lugar en los macrófagos residentes del bazo, hígado y MO, por
el reconocimiento de las proteínas de superficie envejecidas de los GR, seguido de su fagocitosis. Pero en estas patologías, se observa que la destrucción prematura de los
eritrocitos puede ser:
1- Hemólisis extravascular, por lo general se deben a alteraciones del GR que lo hacen menos deformable y dificulta su tránsito por los capilares esplénicos →los
macrófagos residentes secuestran y fagocitan los GR. El cuadro clínico principal de esta hemólisis es: anemia, esplenomegalia e ictericia. Por otro lado, se observa
un descenso de la haptoglobina, que se une a la Hb liberada en la hemólisis.
2- Hemólisis intravascular, donde la lesión de los eritrocitos puede deberse a una lesión mecánica, a la fijación del complemento, parásitos IC (falciparum) o factores
exógenos tóxicos. Con independencia de los mecanismos, el cuadro clínico en todas ellas suele presentar; anemia, hemoglobinemia, hemoglobinuria,
hemosiderinuria e ictericia. Las grandes cantidades de Hb liberada agotan rápidamente la haptoglobina, mientras que la Hb libre se oxida a metaHb, de color
marrón. Las células tubulares renales absorben y catabolizan parte de la Hb y metaHb filtradas, pero una parte se elimina por orina, confiriéndole un color marron-
rojizo. A su vez, el hierro liberado por el Hb puede acumulares dentro de las células tubulares, causando hemosiderosis renal. A diferencia de la hemólisis
extravascular, no se ve esplenomegalia. Cuando el hígado es normal, rara vez se ve ictericia.
Esferocitosis hereditaria (EH). Trastorno hereditario que se debe a defectos intrínsecos del esqueleto de la membrana de los eritrocitos, que les confiere una forma
esférica, menos deformable y más propensa al secuestro y destrucción en el bazo. Como consecuencia de esas alteraciones, la vida de los eritrocitos afectados disminuye a
10-20 días, en comparación con los 120 esperados en GR normales.
, - Morfología. El signo más específico es la esferocitosis, evidente en el frotis como eritrocitos anormalmente pequeños de tinción oscura (hipercrómicos) que carecen
de una zona más pálida; cabe aclarar que, si bien es característica, no es patognomónica. Otras características comunes a todas las anemias hemolíticas:
reticulocitosis, hiperplasia medular eritroide, hemosiderosis e ictericia leve. La esplenomeglia leve es característica, y la colelitiasis se presenta en el 40-50% de los
adultos afectados.
- Características clínicas. El dx se basa en la historia familiar, signos hematológicos y la analítica + una comprobable mayor sensibilidad de los GR a la lisis osmótica. El
cuadro clínico consiste en anemia, esplenomegalia e ictericia, de intensidad variable. En 20-30% de los casos la enfermedad es tan leve que prácticamente es
asintomática, y el descenso de la supervivencia de los eritrocitos se compensa con el aumento de la eritropoyesis; sin embargo, en la mayoría de los casos, los
cambios compensatorios son insuficientes y sobreviene la anemia hemolítica leve/moderada. A veces en el curso de una infección estable, se dan crisis anaplásicas
desencadenadas normalmente por una infección por parvovirus que destruye los progenitores eritrociticos, haciendo que cese la producción de eritrocitos hasta
que comience la respuesta inmune eficaz.
Deficiencia de glucosa-6-fosfato DH. La G6PD reduce el NADP a NADPH a la vez que oxida la glucosa-6-P; NADPH proporciona los equivalentes reductores necesarios para la
conversión del glutatión oxidado a reducido, que protege al medio interno eritrocitario frente al daño oxidativo.
- Etiología. La deficiencia de G6PD es un rasgo recesivo ligado al cromosoma X, por lo que el riesgo de enfermedad sintomática es mayor en hombres. Las variantes
de G6PD asociadas a hemólisis provocan errores de plegamiento de la proteína, hecho que la hace más susceptible a la degradación proteolítica. Como los
eritrocitos maduros no sintetizan proteínas nuevas, se entiende que los GR mayores son más propensos a la hemólisis que los jóvenes → reducción de la vida media
eritrocitaria.
- Patogénesis. La hemólisis episódica es consecuencia de la exposición a situaciones que generan estrés oxidativo; los desencadenantes más frecuentes son las
infecciones (recordar, uno de los mecanismos de defensa inmunitaria es la liberación de EROs), fármacos y algunos alimentos, como el haba (genera oxidantes
cuando se metaboliza). Entonces, la exposición de los eritrocitos con deficiencia de G6PD a niveles altos de oxidantes causa la formación de enlaces covalentes
entre las cadenas de globina, que precipitan y se presentan como los cuerpos de Heinz → inclusiones oscuras dentro de los GR teñidos con violeta cristal. DATAZO:
cuando los GR atraviesan los sinusoides esplénicos, los macrófagos fagocitan las porciones de citoplasma donde se encuentran los cuerpos de Heinz, confiriéndole
el aspecto característico de “células mordidas” vistas en el frotis.
Los oxidantes producen tanto hemólisis intravascular como extravascular → en el primer caso, el daño oxidativo es muy intenso, daña la membrana y se produce la
hemólisis; en el segundo caso, las alteraciones estructurales secundarias al daño oxidativo modifican la elasticidad del GR, por lo que durante su circulación
esplénica, muchos de ellos son capturados y fagocitados por los macrófagos residentes.
- Presentación clínica. La hemólisis intravascular aguda, marcada anemia, hemoglobinemia y la hemoglobinuria comienza 2-3 días después de la exposición de los
sujetos con deficiencia de G6PD a los oxidantes. Como los eritrocitos más antiguos son los que presentan mayor riesgo de lisis, el episodio es autolimitado, ya que la
hemólisis cesa cuando sólo quedan eritrocitos más jóvenes llenos de G6PD. La fase de recuperación se anuncia por la reticulocitosis. El hecho de que la hemólisis
sea episódica explica la ausencia de los signos clásicos de hemólisis crónica, como esplenomegalia o colelitiasis.
Drepanocitosis. Es una hemoglobinopatía hereditaria frecuente causada por una mutación puntual de la βglobina que promueve la polimerización de la Hb desoxigenada,
provocando distorsión de los GR, anemia hemolítica, obstrucción microvascular y lesión tisular isquémica. Las propiedades fisicoquímicas anómalas de la hemoglobina
falciforme (HbS) son las responsables de la enfermedad.
concentración de hemoglobina. Las características morfológicas que aportan las claves etiológicas son el tamaño de los eritrocitos, su grado de hemoglobinización y su
forma. Pero sea cual sea su causa, una anemia lo suficientemente intensa provoca: palidez, debilidad, malestar y fatiga fácil, y la afectación de aquellos órganos más
susceptibles a la caída de O2, como el corazón y SNC.
I- POR PÉRDIDA DE SANGRE
En los casos agudos y masivos, podría llegar a provocar el colapso cardiovascular, shock y muerte. Si el paciente sobrevive a la hemorragia, el volumen circulante se
recompone rápidamente por el desplazamiento de agua desde el IC, que da lugar a una hemodilución y descenso del Hto. La respuesta esperable ante una hemorragia
significativa da lugar a cambios en eritrocitos, leucocitos y plaquetas:
➔ La hipoxia renal desencadena la liberación de Epo, que estimula la proliferación de los progenitores eritroides comprometidos en MO. Dentro de 5 días aprox, su
progenie aparecerá en sangre como reticulocitos (reticulocitosis)
➔ La intensa respuesta adrenérgica encargada de mantener la TA también moviliza los granulocitos desde la reserva marginal y da lugar a una leucocitosis.
➔ Hay trombocitosis por aumento en la producción de plaquetas
II- ANEMIAS HEMOLÍTICAS
Todas comparten los siguientes elementos: reducción de la vida media de los GR, elevación de la Epo como rta compensatoria, acumulación de los productos de
degradación de la Hb (por la hemólisis). Fisiológicamente, la destrucción de los eritrocitos senescentes tiene lugar en los macrófagos residentes del bazo, hígado y MO, por
el reconocimiento de las proteínas de superficie envejecidas de los GR, seguido de su fagocitosis. Pero en estas patologías, se observa que la destrucción prematura de los
eritrocitos puede ser:
1- Hemólisis extravascular, por lo general se deben a alteraciones del GR que lo hacen menos deformable y dificulta su tránsito por los capilares esplénicos →los
macrófagos residentes secuestran y fagocitan los GR. El cuadro clínico principal de esta hemólisis es: anemia, esplenomegalia e ictericia. Por otro lado, se observa
un descenso de la haptoglobina, que se une a la Hb liberada en la hemólisis.
2- Hemólisis intravascular, donde la lesión de los eritrocitos puede deberse a una lesión mecánica, a la fijación del complemento, parásitos IC (falciparum) o factores
exógenos tóxicos. Con independencia de los mecanismos, el cuadro clínico en todas ellas suele presentar; anemia, hemoglobinemia, hemoglobinuria,
hemosiderinuria e ictericia. Las grandes cantidades de Hb liberada agotan rápidamente la haptoglobina, mientras que la Hb libre se oxida a metaHb, de color
marrón. Las células tubulares renales absorben y catabolizan parte de la Hb y metaHb filtradas, pero una parte se elimina por orina, confiriéndole un color marron-
rojizo. A su vez, el hierro liberado por el Hb puede acumulares dentro de las células tubulares, causando hemosiderosis renal. A diferencia de la hemólisis
extravascular, no se ve esplenomegalia. Cuando el hígado es normal, rara vez se ve ictericia.
Esferocitosis hereditaria (EH). Trastorno hereditario que se debe a defectos intrínsecos del esqueleto de la membrana de los eritrocitos, que les confiere una forma
esférica, menos deformable y más propensa al secuestro y destrucción en el bazo. Como consecuencia de esas alteraciones, la vida de los eritrocitos afectados disminuye a
10-20 días, en comparación con los 120 esperados en GR normales.
, - Morfología. El signo más específico es la esferocitosis, evidente en el frotis como eritrocitos anormalmente pequeños de tinción oscura (hipercrómicos) que carecen
de una zona más pálida; cabe aclarar que, si bien es característica, no es patognomónica. Otras características comunes a todas las anemias hemolíticas:
reticulocitosis, hiperplasia medular eritroide, hemosiderosis e ictericia leve. La esplenomeglia leve es característica, y la colelitiasis se presenta en el 40-50% de los
adultos afectados.
- Características clínicas. El dx se basa en la historia familiar, signos hematológicos y la analítica + una comprobable mayor sensibilidad de los GR a la lisis osmótica. El
cuadro clínico consiste en anemia, esplenomegalia e ictericia, de intensidad variable. En 20-30% de los casos la enfermedad es tan leve que prácticamente es
asintomática, y el descenso de la supervivencia de los eritrocitos se compensa con el aumento de la eritropoyesis; sin embargo, en la mayoría de los casos, los
cambios compensatorios son insuficientes y sobreviene la anemia hemolítica leve/moderada. A veces en el curso de una infección estable, se dan crisis anaplásicas
desencadenadas normalmente por una infección por parvovirus que destruye los progenitores eritrociticos, haciendo que cese la producción de eritrocitos hasta
que comience la respuesta inmune eficaz.
Deficiencia de glucosa-6-fosfato DH. La G6PD reduce el NADP a NADPH a la vez que oxida la glucosa-6-P; NADPH proporciona los equivalentes reductores necesarios para la
conversión del glutatión oxidado a reducido, que protege al medio interno eritrocitario frente al daño oxidativo.
- Etiología. La deficiencia de G6PD es un rasgo recesivo ligado al cromosoma X, por lo que el riesgo de enfermedad sintomática es mayor en hombres. Las variantes
de G6PD asociadas a hemólisis provocan errores de plegamiento de la proteína, hecho que la hace más susceptible a la degradación proteolítica. Como los
eritrocitos maduros no sintetizan proteínas nuevas, se entiende que los GR mayores son más propensos a la hemólisis que los jóvenes → reducción de la vida media
eritrocitaria.
- Patogénesis. La hemólisis episódica es consecuencia de la exposición a situaciones que generan estrés oxidativo; los desencadenantes más frecuentes son las
infecciones (recordar, uno de los mecanismos de defensa inmunitaria es la liberación de EROs), fármacos y algunos alimentos, como el haba (genera oxidantes
cuando se metaboliza). Entonces, la exposición de los eritrocitos con deficiencia de G6PD a niveles altos de oxidantes causa la formación de enlaces covalentes
entre las cadenas de globina, que precipitan y se presentan como los cuerpos de Heinz → inclusiones oscuras dentro de los GR teñidos con violeta cristal. DATAZO:
cuando los GR atraviesan los sinusoides esplénicos, los macrófagos fagocitan las porciones de citoplasma donde se encuentran los cuerpos de Heinz, confiriéndole
el aspecto característico de “células mordidas” vistas en el frotis.
Los oxidantes producen tanto hemólisis intravascular como extravascular → en el primer caso, el daño oxidativo es muy intenso, daña la membrana y se produce la
hemólisis; en el segundo caso, las alteraciones estructurales secundarias al daño oxidativo modifican la elasticidad del GR, por lo que durante su circulación
esplénica, muchos de ellos son capturados y fagocitados por los macrófagos residentes.
- Presentación clínica. La hemólisis intravascular aguda, marcada anemia, hemoglobinemia y la hemoglobinuria comienza 2-3 días después de la exposición de los
sujetos con deficiencia de G6PD a los oxidantes. Como los eritrocitos más antiguos son los que presentan mayor riesgo de lisis, el episodio es autolimitado, ya que la
hemólisis cesa cuando sólo quedan eritrocitos más jóvenes llenos de G6PD. La fase de recuperación se anuncia por la reticulocitosis. El hecho de que la hemólisis
sea episódica explica la ausencia de los signos clásicos de hemólisis crónica, como esplenomegalia o colelitiasis.
Drepanocitosis. Es una hemoglobinopatía hereditaria frecuente causada por una mutación puntual de la βglobina que promueve la polimerización de la Hb desoxigenada,
provocando distorsión de los GR, anemia hemolítica, obstrucción microvascular y lesión tisular isquémica. Las propiedades fisicoquímicas anómalas de la hemoglobina
falciforme (HbS) son las responsables de la enfermedad.