Dipol
Definition:
Dipol → „di“ = 2 Pole
Molekül, das stark polar ist (polare Atombindung) und dessen 2 Ladungsschwerpunkte nicht
auf einen Punkt zusammentreffen
Beispiele:
Wassermolekül, Fluorwasserstoffmolekül, Chlorwasserstoffmolekül
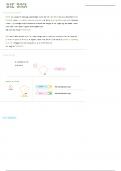
Schreibweise:
Dreiecksform wichtig → dadurch fallen Ladungsschwerpunkte NICHT aufeinander → Dipolcharakter
Keine Dreiecksform → H-O-H → Ladungsschwerpunkte fallen aufeinander → FLASCH!
Dipol Wasser:
- Negative Ladungsschwerpunkt: Sauerstoffatom (EN = 3,4)
- Positiver Ladungsschwerpunkt: liegt zwischen beiden Wasserstoffatomen (EN = 2,2)
- Beide Ladungsschwerpunkte fallen nicht zusammen
- Sauerstoff ist stärker negativ geladen (wegen höherer EN) und ist deshalb negativ teilgeladen
- Wasserstoff ist weniger stark geladen (niedrigere EN) und ist deshalb positiv teilgeladen
- Teilgeladen = keine echte Ladung; Molekül insgesamt neutral, Bindungselektronenpaar wird
stärker zum Sauerstoff gezogen
- Dipol → negative und positive Teilladung → kann sehr gute Wasserstoffbrückenbindungen
ausbilden
- Voraussetzung Wasserstoffbrückenbildung: 1 freies Elektronenpaar, ein positiv teilgeladenes
Wasserstoffatom
- Wasserstoffbrückenbindungen (hält Wassermoleküle zusammen, stärksten
intermollekularen Bindungen die es gibt) bilden sich zwischen freiem Elektronenpaar von
Sauerstoff und H von einem anderem Wasser → dadurch kann sich kristallartige Struktur
bilden (Oberflächenspannung vom Wasser)
- Eigenschaft von Polarität: Sobald ein Molekül polar ist, hat dieses automatisch negative und
positive teilgeladene Moleküle
(EN = Elektronennegativität)
Definition:
Dipol → „di“ = 2 Pole
Molekül, das stark polar ist (polare Atombindung) und dessen 2 Ladungsschwerpunkte nicht
auf einen Punkt zusammentreffen
Beispiele:
Wassermolekül, Fluorwasserstoffmolekül, Chlorwasserstoffmolekül
Schreibweise:
Dreiecksform wichtig → dadurch fallen Ladungsschwerpunkte NICHT aufeinander → Dipolcharakter
Keine Dreiecksform → H-O-H → Ladungsschwerpunkte fallen aufeinander → FLASCH!
Dipol Wasser:
- Negative Ladungsschwerpunkt: Sauerstoffatom (EN = 3,4)
- Positiver Ladungsschwerpunkt: liegt zwischen beiden Wasserstoffatomen (EN = 2,2)
- Beide Ladungsschwerpunkte fallen nicht zusammen
- Sauerstoff ist stärker negativ geladen (wegen höherer EN) und ist deshalb negativ teilgeladen
- Wasserstoff ist weniger stark geladen (niedrigere EN) und ist deshalb positiv teilgeladen
- Teilgeladen = keine echte Ladung; Molekül insgesamt neutral, Bindungselektronenpaar wird
stärker zum Sauerstoff gezogen
- Dipol → negative und positive Teilladung → kann sehr gute Wasserstoffbrückenbindungen
ausbilden
- Voraussetzung Wasserstoffbrückenbildung: 1 freies Elektronenpaar, ein positiv teilgeladenes
Wasserstoffatom
- Wasserstoffbrückenbindungen (hält Wassermoleküle zusammen, stärksten
intermollekularen Bindungen die es gibt) bilden sich zwischen freiem Elektronenpaar von
Sauerstoff und H von einem anderem Wasser → dadurch kann sich kristallartige Struktur
bilden (Oberflächenspannung vom Wasser)
- Eigenschaft von Polarität: Sobald ein Molekül polar ist, hat dieses automatisch negative und
positive teilgeladene Moleküle
(EN = Elektronennegativität)