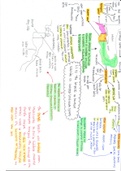
Inhibitie en activatie van de
enzymatische reactie
Reversibele inhibitoren
Inhibitor bindt aan een enzyme en zal zeer snel dissociëren
o Vormen onstabiele complexen met het enzym
o Er ontstaat een evenwicht verantwoordelijk voor een constante graad van inhibitie
Afhankelijk van concentraties [E], [S] en [I]
Competitieve inhibitor
Inhibitor bindt op dezelfde plaats als het substraat zou binden
Heeft een effect op de Km-waarde
o Hoe meer inhibitor er aanwezig is, hoe minder substraat kan binden en hoe meer
inhibitie zal optreden
Indien toch voldoende [E] en minder [S] zal de maximale snelheid toch
behaald kunnen worden
[I ]
o De Km-waarde zal vermenigvuldigd worden met waarde ∝ welke gelijk aan 1+
( )
K3
[ E] [ I ]
Met K 3=
[ EI ]
, Doordat Km zal beïnvloed worden zien we dat de hyperbool van
Michaelis-Menten curve zal afvlakken
[I ]
app
Nieuwe Km = K m = 1+
( K3 ) ∗K m
Niet-competitieve inhibitor
Inhibitor bindt op een andere plaats, maar geeft zo een conformationele verandering van de
actieve site → substraat kan niet langer meer binden
o Substraatbinding wordt niet verhindert (K m blijft dezelfde) maar de katalyse wordt
geïnhibeerd → daling in de maximale snelheid Vmax
1
Vmax wordt gedeeld door een waarde ∝ welke gelijk is aan [I ]
1+
K3
Doordat Vmax beïnvloed wordt door een factor ∝ zien we dat de
Michaelis-Menten curve sneller zijn maximum zal bereiken
app V max
V max =
Nieuwe Vmax = [I ]
1+
K3
enzymatische reactie
Reversibele inhibitoren
Inhibitor bindt aan een enzyme en zal zeer snel dissociëren
o Vormen onstabiele complexen met het enzym
o Er ontstaat een evenwicht verantwoordelijk voor een constante graad van inhibitie
Afhankelijk van concentraties [E], [S] en [I]
Competitieve inhibitor
Inhibitor bindt op dezelfde plaats als het substraat zou binden
Heeft een effect op de Km-waarde
o Hoe meer inhibitor er aanwezig is, hoe minder substraat kan binden en hoe meer
inhibitie zal optreden
Indien toch voldoende [E] en minder [S] zal de maximale snelheid toch
behaald kunnen worden
[I ]
o De Km-waarde zal vermenigvuldigd worden met waarde ∝ welke gelijk aan 1+
( )
K3
[ E] [ I ]
Met K 3=
[ EI ]
, Doordat Km zal beïnvloed worden zien we dat de hyperbool van
Michaelis-Menten curve zal afvlakken
[I ]
app
Nieuwe Km = K m = 1+
( K3 ) ∗K m
Niet-competitieve inhibitor
Inhibitor bindt op een andere plaats, maar geeft zo een conformationele verandering van de
actieve site → substraat kan niet langer meer binden
o Substraatbinding wordt niet verhindert (K m blijft dezelfde) maar de katalyse wordt
geïnhibeerd → daling in de maximale snelheid Vmax
1
Vmax wordt gedeeld door een waarde ∝ welke gelijk is aan [I ]
1+
K3
Doordat Vmax beïnvloed wordt door een factor ∝ zien we dat de
Michaelis-Menten curve sneller zijn maximum zal bereiken
app V max
V max =
Nieuwe Vmax = [I ]
1+
K3