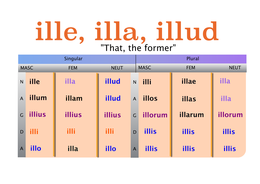
Naam van de wet Wat wordt Naam Formules Grafisch Tekening deeltjesmodel Uitleg deeltjesmodel
er constant proces
gehouden?
T Isotherm Bij een kleiner volume krijgen
De Wet van Boyle temperatuur P(bar) we meer botsingen per opp.
en Mariotte Dus meer kracht en meer druk.
P1*V1= P2*V2
V (ml)
V isochoor Temperatuur stijgt deeltjes
P(hPa)
Drukwet van Gay- Volume hebben een hogere snelheid
Lussac meer botsingen per opp. Dus
P1/T1=P2/T2 een hogere druk.
0° T(K)
273K
P Isobaar Temperatuur stijgt dus gaan we
Drukwet van Gay- Druk de delen sneller bewegen,
Lussac V1/T1 = V2/T2 deeltjes duwen de wand naar
boven/buiten dus een groter
volume en de druk blijft daarom
dus hetzelfde.
, Toestandsfactoren
1) Het volume V is het volume van het vat waarin het gas opgesloten zit en niet het volume van de gasmoleculen waaruit het gas bestaat.
2) De druk p is de verhouding van de kracht die de gasmoleculen door botsingen op een vlak uitoefenen tot de oppervlakte van dat vlak.
3) De temperatuur 0 (celciustemperatuur) of T (kelvintemperatuur) is een maat voor de gemiddelde snelheid en voor de gemiddelde
kinetische energie van de gasmoleculen.
Voorbeeld:
1) Als het volume van een ballon verkleint door erop te duwen kan deze stuk gaan door de grote druk in de ballon
2) Als je een ballon een tijdje in de koelkast legt, merk je dat de ballon zijn volume kleiner geworden.
Verandering van 1 van de toestandsfactoren= toestandsverandering
Tcst=> verband tussen p en V (Isotherm)
Vcst=> verband tussen p en T (Isochoor)
Pcst=> verband tussen V en T (Isobaar)
Geldigheid van de gaswetten:
- reële en ideale gassen
Alle gassen zijn reële gassen. Zij volgen de gaswetten in een beperkt temperatuurgebied:
1) Bij hoge temperaturen
=> ontbinden gasmoleculen in kleinere moleculen waardoor hun aantal plots toeneemt=> gaswetten gelden niet meer
2) Bij voldoende lage temperatuur: door cohesiekrachten
=> condenseert een gas en wordt het………………………………………………….
(een vaste stof worden)
=> desublimeren van gas en wordt het een…………………………………………
=> we hebben geen gas meer
Meestal gedragen gassen zich als ideale gassen
er constant proces
gehouden?
T Isotherm Bij een kleiner volume krijgen
De Wet van Boyle temperatuur P(bar) we meer botsingen per opp.
en Mariotte Dus meer kracht en meer druk.
P1*V1= P2*V2
V (ml)
V isochoor Temperatuur stijgt deeltjes
P(hPa)
Drukwet van Gay- Volume hebben een hogere snelheid
Lussac meer botsingen per opp. Dus
P1/T1=P2/T2 een hogere druk.
0° T(K)
273K
P Isobaar Temperatuur stijgt dus gaan we
Drukwet van Gay- Druk de delen sneller bewegen,
Lussac V1/T1 = V2/T2 deeltjes duwen de wand naar
boven/buiten dus een groter
volume en de druk blijft daarom
dus hetzelfde.
, Toestandsfactoren
1) Het volume V is het volume van het vat waarin het gas opgesloten zit en niet het volume van de gasmoleculen waaruit het gas bestaat.
2) De druk p is de verhouding van de kracht die de gasmoleculen door botsingen op een vlak uitoefenen tot de oppervlakte van dat vlak.
3) De temperatuur 0 (celciustemperatuur) of T (kelvintemperatuur) is een maat voor de gemiddelde snelheid en voor de gemiddelde
kinetische energie van de gasmoleculen.
Voorbeeld:
1) Als het volume van een ballon verkleint door erop te duwen kan deze stuk gaan door de grote druk in de ballon
2) Als je een ballon een tijdje in de koelkast legt, merk je dat de ballon zijn volume kleiner geworden.
Verandering van 1 van de toestandsfactoren= toestandsverandering
Tcst=> verband tussen p en V (Isotherm)
Vcst=> verband tussen p en T (Isochoor)
Pcst=> verband tussen V en T (Isobaar)
Geldigheid van de gaswetten:
- reële en ideale gassen
Alle gassen zijn reële gassen. Zij volgen de gaswetten in een beperkt temperatuurgebied:
1) Bij hoge temperaturen
=> ontbinden gasmoleculen in kleinere moleculen waardoor hun aantal plots toeneemt=> gaswetten gelden niet meer
2) Bij voldoende lage temperatuur: door cohesiekrachten
=> condenseert een gas en wordt het………………………………………………….
(een vaste stof worden)
=> desublimeren van gas en wordt het een…………………………………………
=> we hebben geen gas meer
Meestal gedragen gassen zich als ideale gassen